Previous Project
研究内容
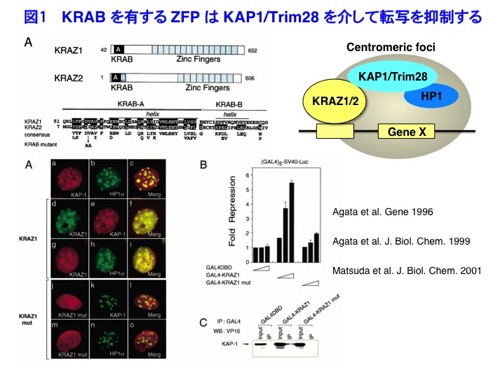
遺伝子の転写や組換えには、ヒストン修飾をはじめとするエピジェネティックな制御が重要な役割を果たします。私たちは、免疫細胞におけるエピジェネティックな分化制御機構に興味を持ち、主に抗原受容体遺伝子の再構成をモデルとして研究を行なって来ました。 1)転写抑制因子の単離とその転写抑制機構に関する研究 私は金沢大学医学部を卒業したのち、京都大学大学院医化学教室において本庶 佑教授のもと、T細胞の抑制レセプターでありますPD-1遺伝子の単離と抗体の作製を行ない、PD-1が抗原受容体刺激により発現が誘導されることを明らかにしました(EMBO J. 1992, Int. Immunol.1996)。大学院修了後、京都大学遺伝子実験施設で清水 章教授の助手として、新しいKruppel-like Zinc Finger Protein遺伝子の単離を行ない、免疫細胞に発現する新規KRAB-Zinc Finger ProteinがKAP1/TIF1β/TRIM28というコリプレッサーを介して標的遺伝子をヘテロクロマチン領域に移動させ、ヒストン脱アセチル化に依存して転写を抑制することを示しました(JBC 1999, JBC 2001、図1)。
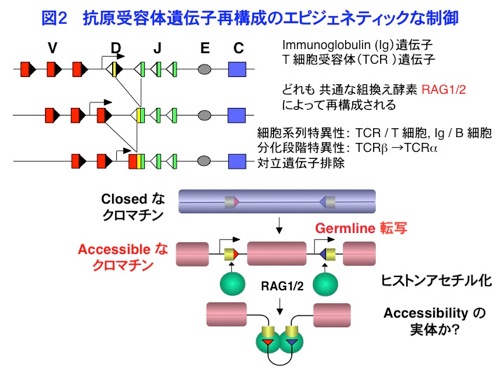
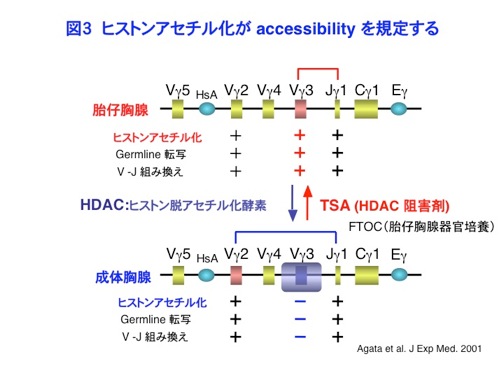
2)ヒストン修飾による組換えと細胞分化の制御機構に関する研究 抗原受容体遺伝子には、T細胞受容体(TCR)遺伝子とイムノグロブリン(Ig)遺伝子が複数ありますが、どれも共通な組換え酵素RAG1/2によって再構成されます。しかしTCR遺伝子はT細胞だけで再構成し、Ig遺伝子はB細胞だけで再構成するといった細胞系列特異性や、同じT細胞でも、まずTCRβが組換えを起こしたのち、TCRαが組換えを起こすといった分化段階特異性があります。さらに、機能的な組換えが片方の相同染色体に限って起こる対立遺伝子排除という現象がありますが、これらの現象を説明するためにaccessibilityモデルという仮説が提唱されていました(図2)。すなわち組換えにさきがけて、組換えの標的部位において、Germline転写と呼ばれる転写が起こることから、closedなクロマチンが細胞系列や分化段階特異的にオープンになって、RAGに対してaccessibleになるというモデルです。しかしながら、accessibilityの実体は長く不明なままでした。 私たちがこの研究を開始した1997年頃、転写のコアクティベーターであるp300/CBPが、ヒストンアセチル化酵素であるという発見があり、ヒストンのアセチル化が転写の活性化に機能的に関連することが明らかになって来ました。そこで私は、accessibilityの実体がヒストンのアセチル化ではないかと考え、クロマチン免疫沈降法(ChIP)を立ち上げ、マウスのTCRγ遺伝子を対象にして解析をはじめました。マウスのTCRγ遺伝子は、4つのVγ遺伝子と1つのJγ1遺伝子からなるシンプルな構造をしています。また胎児の胸腺では、主に1番下流のVγ3遺伝子が組換えを起こしますが、成体の胸腺ではその組換えは顕著に抑制され、代わりに上流のVγ2遺伝子組換えが主体になります。そこでそれぞれのヒストンアセチル化をChIPにより解析したところ、Vγ3のヒストンアセチル化がGermline転写や組換えとよく相関して、胎児では高いのに対して、成体では低下することがわかりました。すなわち、成体胸腺ではヒストン脱アセチル化酵素(HDAC)がVγ3領域に特異的にリクルートされていることが示唆されました。そこでHDACの阻害剤であるトリコスタチンA(TSA)存在下で胎仔胸腺器官培養を行なったところ、成体骨髄由来の幹細胞からでもVγ3のヒストンアセチル化を上昇させ、組換えを誘導することができました。このことから、ヒストンのアセチル化がaccessibilityを規定する機能的な実体であることを明らかにすることができました(Agata et al. J.Exp.Med. 2001,図3)。またこの結果は、本来Vγ2細胞になるように運命付けられた成体骨髄由来の幹細胞が、エピジェネティックな変化によって、胎児型のVγ3細胞へとリプログラムできたことを示すものでもあります。さらにこの研究を発展させ、IL-7Rのシグナル分子であるSTAT5がヒストンアセチル化酵素p300/CBPをJγ遺伝子に動員し、組換えを誘導することを、京都大学ウイルス研究所の生田宏一先生との共同研究によって示すことができました(Ye et al. Immunity 2001)。
3)E2Aによる遺伝子再構成と対立遺伝子排除の制御機構に関する研究
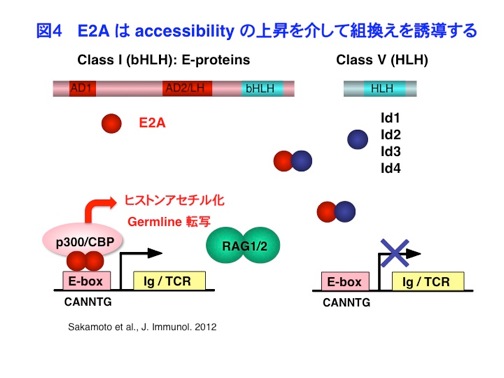
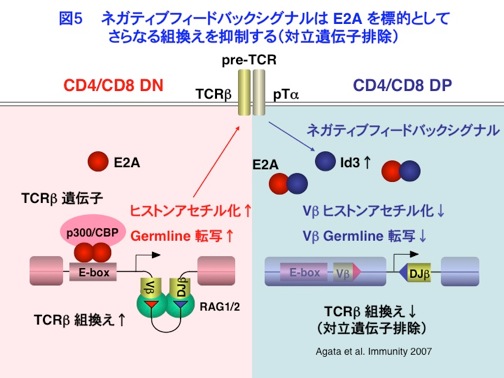
遺伝子再構成の分子機構についてさらに研究を進めるために、UCSDのCornelis Murre博士の研究室に留学し、組換え制御に中心的な役割を果たすE2A転写因子について研究を行いました。E2AはIgκ遺伝子のエンハンサーに結合するHelix-Loop-Helix(HLH)転写因子としてMurre博士によって同定された転写因子です。私たちは、E2AがIgκやTCR遺伝子の近傍にあるE-boxという配列に結合し、p300/CBPをリクルートしてヒストンアセチル化を上昇させ、組換えを誘導することを明らかにしました(Sakamoto et al. J. Immunol. 2012, 図4)。一方、Idと呼ばれるHLH因子は、E2Aとヘテロダイマーを形成し、そのDNA結合を阻害することによって転写を抑制します。また、E2Aがクラススイッチ組換えに必須であるAIDの転写を活性化することにより、クラススイッチ組換えも誘導することなども示しました(Sayegh et al. Nat.Immunol. 2003)。 帰国後、京都大学・先端領域融合医学研究機構において独立したグループを率いて新しい研究を開始し、TCRβ遺伝子の対立遺伝子排除について研究を行ないました。対立遺伝子排除は、機能的な組換えが片方の相同染色体に限って起こるという現象であり、1つのリンパ球が1種類の抗原にのみ反応するというクローン選択説の拠り所となる現象です。もし対立遺伝子排除が破綻して2つの受容体が発現し、その一方が自己反応性であった場合、自己免疫疾患が発症する可能性も考えられることから非常に重要な機構です。 そのメカニズムとしては、ネガティブフィードバックモデルというものが考えられていました。すなわち、TCRβ遺伝子はCD4/CD8 Double Negative(DN)胸腺細胞でaccessibilityが上昇し、組換えを起こしますが、組換えに成功し、産生されたTCRβ鎖はpTα鎖とともにpre-TCRを形成し、シグナルを伝達します。このシグナルにより、細胞はCD4/CD8 Double Positive(DP)細胞へと増殖、分化するとともに、なんらかのネガティブフィードバックシグナルによって、Vβ領域のaccessibilityが特異的に低下し、さらなる組換えが抑制され、それによって機能的な組換えが片方の相同染色体に限られると考えられて来ました。しかしながら、ネガティブフィードバックシグナルの標的因子は長く不明でした。 そこで私たちは、TCRβ遺伝子におけるE2Aの結合をChIPで調べたところ、DN細胞ではE2AがVβ領域やDJβ領域やその下流のエンハンサーに結合するのに対し、DP細胞ではE2AのインヒビターであるId3が顕著に誘導され、E2AがVβ領域から特異的に引き離されることにより、さらなる組換えが抑制されるということを明らかにしました(Agata et al. Immunity 2007, 図5)。この結果は、ネガティブフィードバックシグナルの標的因子がE2Aであることを明らかにし、対立遺伝子排除の核内分子機構をはじめて解明したものです。
4)染色体高次構造変化による遺伝子再構成の制御機構に関する研究
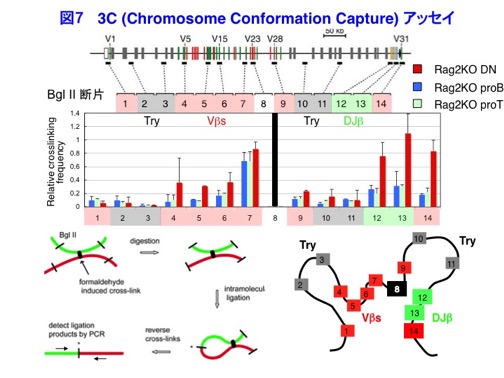
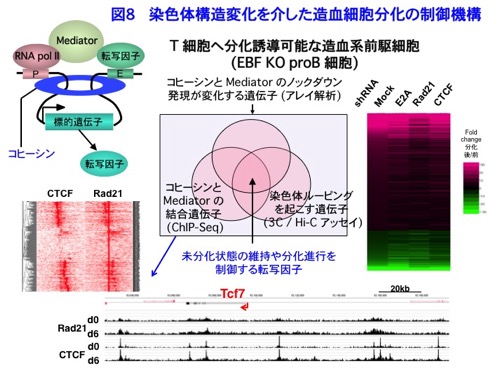
一方、TSAによってDP細胞でヒストンアセチル化を上昇させても組換えは起こらないことから、accessibilityの上昇だけでは十分でないことがわかりました。しかしながら、E2AをDP細胞で過剰発現させると組換えが誘導できることから、E2Aはaccessibilityの上昇に加えて何かしていることが示唆されました。すなわち、E2Aは局所のクロマチンをオープンにするだけでなく、染色体ルーピングによってV領域とDJ領域を近づけるのではないかと考えました。 そこで、3次元構造の維持された核内で染色体領域を可視化する3D DNA FISHという方法を用いて調べたところ、組換えの起こるDN細胞ではV領域とDJ領域が接近しているのに対して、組換えが抑制されるDP細胞ではこれらの領域が離れて存在することがわかりました。さらにE2AをDP細胞で過剰発現させるとDN細胞と同程度に接近が起きることから、E2Aが染色体ルーピングによっても組換えを誘導することを見いだしました(図6→追記:未発表データのため図を削除いたしました。悪しからずご了承ください(2014/7/3))。現在、さらに高解像度で染色体構造を解析するために、Chromosome Conformation Capture 3Cアッセイによっても解析を行っています(図7)。 染色体のルーピングを司る因子として、染色体分配に関わるコヒーシン複合体が示唆されています。またコヒーシンに加え、Mediatorと呼ばれる転写共役因子がNanogやOct4遺伝子のルーピングを介してES細胞の分化を制御することが報告されています。そこで、新しい試みとして、T細胞へ分化誘導できる造血系前駆細胞の培養系を用いて、これらの因子をノックダウンし、遺伝子発現パターンや染色体構造変化等について網羅的かつ複合的な解析を行ない、分化制御の鍵となる転写因子やそのネットワークを同定することも開始しています(図8)。
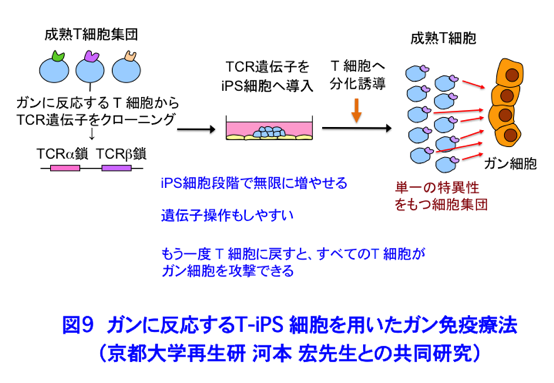
5) iPS細胞技術を利用したガン免疫療法に関する研究 New!上述のように、私は京都大学医学部大学院で本庶 佑先生のもと、PD-1という遺伝子の単離と解析を行いましたが、PD-1に対する抗体が様々なガンに治療効果があることがわかり、昨年認可され実際の治療に使われるようになりました。自分が発見に関わった分子が、人の命を救う治療に貢献できるということは、研究者冥利に尽きることです。そこで、そのような治療に直結する可能性のある、新しいT-iPSプロジェクトに参画しています。これは、京都大学再生研の河本 宏先生を中心に進められているもので、がんに特異的に発現する抗原に対して反応できるヒトのT細胞からTCR遺伝子をクローニングし、iPS細胞に導入し大量培養したのちにT細胞へと分化誘導して、がんの免疫療法に用いるという試みです(図9)。既にいくつかのがん抗原に対して作製したiPS細胞由来のT細胞が、実際にがん細胞を傷害する活性を持つことが明らかになっています。