分子イメージングを目指すMR画像法
滋賀医科大学 MR医学総合研究センター犬伏 俊郎
要 約
再生医療や細胞治療で用いるES細胞などの治療用細胞を生体内で可視化する技術が切望されている。その一つの方法として、移植細胞に常磁性の標識を取り込ませ、核磁気共鳴(MR)法を利用して移植細胞の無侵襲追跡が可能になってきた。本稿では、MR法が細胞識別を可能にする原理から、MRのための標識法、実験動物における標識細胞の長期無侵襲追跡などを紹介するとともに、あわせて、MR細胞追跡法の課題や展望についてまとめたい。
1.はじめに
今日、核磁気共鳴(Nuclear Magnetic Resonance; NMR)法は一般の人にも身近な存在になってきた。例えば、日常の臨床診断ではMR画像(MRI)がもはや欠かすことができない画像診断法にまで到達している。一方で、大学や研究所で活躍してきたNMRスペクトロスコピー法(古い呼び方では核磁気共鳴分光法)は、今や核酸やタンパク質の構造解析は言うに及ばず、それらの機能の究明に活躍し、プロテオーム研究の一翼を担うまでになっている。このNMR法の二つの潮流が合流するとその流れは一体どこへ向かうのであろうか?
一つの方向性は、生物が生きた状態のまま外部から生体内での細胞・分子がつかさどる活動(つまり遺伝子やタンパク質)の様態を考察する「分子イメージング」と考えられている。医療や医学の分野では大きな変化が起こりつつあり、なかでも遺伝子の情報を駆使した医療はもはや実行段階に達し、さらにES細胞や幹細胞を利用する再生医療が目前に迫りつつある。急速に発展しつつあるこの分野で、非侵襲的に遺伝子発現の可視化や、移植細胞、特にES細胞の体内での位置を特定する新しい画像法が必要になってきたからである。このための画像法として分子イメージングへの期待が高まっている。本稿では、狭い意味では分子イメージングに入らないが、MR画像法による生体内の移植幹細胞追跡の現状を中心に、MRによる分子イメージングの一端を紹介し、その将来性についても概観したい。
2.動物実験用7テスラMRI装置の概要
MRによる分子イメージングについて詳述する前に、我々が使用している磁場強度7テスラの動物実験用MR装置について簡単に紹介しておこう。本装置には、直径40cmの開口部を持つ、高さ約2m(冷媒補充用のサービスポートや上部に設置された冷凍機を含めると2m50cmになる)、長さ1m80cmの超伝導磁石(JASTEC社製)が付備されている(図1)。この磁石にはアクティブ・シールド用の磁石が取り付けられ、主コイルで発生する外向きの磁場を打ち消す方向に磁場がつくられているため、磁石側面での遺漏磁場は十ガウス程度に抑えられる。したがって、ここではほとんど磁場の影響を受けない領域が得られている。また、この磁石には、ウサギやサルなどの中型動物のMR画像計測用に傾斜磁場コイル(内径26cm)とマウス・ラットなどの小型動物用の傾斜磁場コイル(内径12cm)を取り付けることができる。動物の大きさで臨機応変に装置の設定が変更できることになる。
  |
| 図1 滋賀医科大学、MR医学総合研究センターに整備された動物実験用7テスラMR装置の磁石 遺漏磁場を抑制するアクティブ・シールド型磁石を装備する。また、冷凍機の作動を制御して、超伝導磁石の冷媒である液体ヘリウムが気化した分だけを液化して戻すシステムを持ち、冷媒の補充を必要としない(ゼロボイルオフ)。ただし、冷凍機は常時運転させるため、1-2年で交換する必要がある。 |
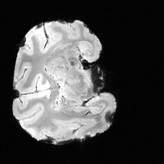
MRのコンソールはVarian社製Inova 300で、15N(共鳴周波数:30MHz)から1H(300MHz)までのあらゆる核種に対応し、例えば、13C(75MHz)、19F(282MHz)、23Na(79MHz)、31P(121.5MHz)、などの他核のMRが観測できる。そして、これら核種のMR画像(MRI)とNMRスペクトル(MRS)の両方が計測できる。信号検出用のRFコイルとして、直径19cmと6cmの市販体積コイルが装備され、それぞれ、サルやラットなどのMR画像撮像に使われる。MR信号の検出器(コイルと通常は呼ぶ)は対象とする動物の大きさや計測する部位、例えば、頭部(脳)、腹部(心臓、肝臓)、下肢(骨格筋)等に対応して、その大きさや形が異なり、さらに、計測する核種によっても共鳴周波数を得る同調回路のパラメータが違うため、それぞれの測定対象に応じて信号検出器を作製する事になる。このために必要な、非磁性体電子素材や高周波回路の計測機器などが我々のセンターには整備されている。ちなみに、本学動物生命科学研究センターの鳥居教授のご協力により自作コイルを用いて7テスラMR装置で撮像した、カニクイザルの脳の摘出標本の3次元データを図2に示した。
 |
 |
| 図2 7テスラMR装置によるカニクイザルの脳標本のMR画像。 3Dグラディエント・エコーのデータ(左)を3次元画像(右)に変換した。 |
|
3.MR法の特徴とMR標識剤
MR画像信号の起源は正確に記述すると、生体中の水分子の水素原子核の磁性に由来する。その核磁性をMR信号として検出し、その強度を平面の位置情報に対応して表示し、画像にしたものである。このことからMR信号の強度は、元々の水分子の数、即ち、その濃度に比例することは明らかである。さらに、MR信号は緩和時間と呼ばれる、信号の生成や消滅過程に関連するパラメータにも依存する。MR画像法で、病巣の明瞭なコントラストが得られ理由は、病巣に含まれる水分子のMR信号が持つ緩和時間が、辺縁の正常な組織中の水分子の緩和時間と異なることによる。このMR信号の緩和時間に、縦緩和時間(T1)と横緩和時間(T2)が含まれ、MR画像診断では、T1-強調画像やT2-強調画像が一般的に使われている。
MR画像で病巣をさらに鮮明に浮かび上がらせようとすると、病巣と正常組織の間で緩和時間の差をより大きくする必要がある。MR画像法では造影剤と呼ばれ、病巣部の水分子と選択的に相互作用をし、そのMR信号の緩和時間を短縮させる常磁性の試薬(MRでは造影剤と呼ばれる)を採用する。一般に常磁性金属イオンはMR信号の緩和和時間の短縮効果を持つが、中でもその効果が際立つ緩和試薬としてガドリニウム・イオンのキレート剤が臨床では造影剤として利用される。ただし、ガドリニウム・イオン自体は猛毒であるため、キレートに強固に配位したまま、体外に排出されるように分子設計がなされている。このような造影剤は、白黒のMR画像ではあたかも白か黒の絵の具のように働く。例えば、MR信号の強度が減少すれば、MR画像では黒く映り(主としてT2-強調画像)、逆に、信号強度が相対的に増強するとMR画像では白く見える画像コントラストが得られる。また、このような造影剤を血管内に導入すると、血液とともに造影剤が組織内に流れ込み、水の流れが絵の具の色で捕らえられるように、造影剤の画像に及ぼす一過性の変化を観測し、血流の速度や容量の変化も計測することができる。
MRの造影剤は上述のような使われ方以外に、分子イメージングでの細胞や分子の認識に応用することが可能である。これまでに、特定のタンパク質に対する抗体にMR造影剤を担わせ、目的のタンパク質に結合した部位にコントラストを与えて画像化する、タンパク質の画像化法が試みられてきた1)。中でも、細胞膜に局在するタンパク質に対する抗体を用いれば、タンパク質を介して細胞が特定できることになる。このようなMR造影剤を使った手法は80 年代の後半から始められたものの、タンパク質の濃度が低い上、造影剤自身の緩和時間短縮効果も限られていたため、これまでは注目されるほどの目覚しい成果は上げられてこなかった。しかし、最近になって超常磁性酸化鉄(Super Paramagnetic Iron Oxide: SPIO)と総称される非常に強力な造影剤が開発され、これまでの障壁のひとつが乗り越えられ、まさに細胞に絵の具で色をつけ、その色をMR画像で追跡できることが可能となった。
最近、Bulte等2)は高分子化合物であるデンドリマーに常磁性金属を担わせた新しい造影剤を開発した。この造影剤は細胞表面のタンパク質を標的とせず、細胞膜の中へ直接挿入することを狙ったMR造影剤である。その後、市販の遺伝子導入剤がこれもまた市販のMR造影剤であるSPIO(肝臓用の陰性MR造影剤)を細胞内へ導入できることが分かり、細胞標識がさらに容易になってきた。実際、神経幹細胞に USPIO(Ultra small SPIO) を導入し、ラット脳の虚血モデルで、標識された移植幹細胞が虚血により障害を受けた部位に移動することが MRIで確認されている3)。しかし、MR造影剤は酸化鉄とそれを包むデキストランで構成されており、通常負の電荷を持つとは予想されない。陽イオン性の遺伝子導入剤が、遺伝子の様に陰イオンではない常磁性鉄粒子を細胞内へどのようにして移送するのかは、まだ解答が得られていない。このことから、標識試薬の性質に左右されない、さらに効率の良い細胞への導入技術が開発されるであろうと推察された。つい最近、これまでの細胞の標識化やMRによる細胞追跡のまとめが、これまでの経緯がまとめられているので参照されたい4)。
4.効率的な細胞の磁気的標識法
ここからは、我々が採用している細胞標識法を紹介しておこう5)。標識剤には MRIの陰性の造影剤として普及している超常磁性酸化鉄 (Super Paramagnetic Iron Oxide : SPIO) の、フェリデックス(田辺製薬)とレゾビスト(日本シェーリング)を使用した。一方、これらの標識剤を細胞内へ移送する方法として、大阪大学遺伝子治療教室(金田教授)で開発された、遺伝子導入のための膜融合活性を持つセンダイウイルスのベクター・エンベロープ (Hemagglutinating Virus of Japan, HVJ-E: Genom One、石原産業)6)を使用した。このベクターは元々遺伝子導入のために開発されたものであるが、たんぱく質や薬物の細胞内への輸送にも優れた効果を発揮する。
我々はES細胞への常磁性標識を試みる前に、一般の培養細胞を用いて、HVJ-Eによる標識の細胞内への移送効率を検討した。標識を施す細胞には、ニューロンの代表としてラット副腎由来の PC12 細胞と、グリアの代表としてマウスのアストロサイトを選び、標識導入の条件を探索した。
これまでに国外の施設では、我々が使用したのと同様の常磁性鉄製剤をMR標識に、そして、遺伝子導入剤として市販されている試薬を用いた。まず、遺伝子導入剤について簡単に触れておこう。元来、遺伝子は負の電荷を帯び、電気的には負の電荷を持つ標的の細胞膜と親和性が乏しいため、そのままでは膜内へ遺伝子を導入することが難しい。従って、一般の遺伝子導入剤は、陽イオン性のポリマーやペプチド、あるいは脂質などからなり、容易に遺伝子との静電的な複合体を形成して、細胞膜を通過させることになる。ところが、MR標識に用いられる鉄製剤は負の電荷を持つものでなく、市販の遺伝子導入剤との間に強い相互作用を持つとは考えにくい。その点、HVJ-Eは遺伝子のみならず、タンパク質や薬物など電荷に関係なく、多様な化学物質を取り込み、標的細胞の膜内へと移送することができる。したがって、MR画像の標識に用いる鉄製剤に対しては遺伝子導入剤よりもHVJ-Eの方が効率のよいことが期待される。実際、PC12細胞を用いて、フェリデックスの細胞内への導入をHVJ-Eで行ってみた。そして、鉄染色の結果も、細胞内にこの標識が取り込まれていることを確認した。
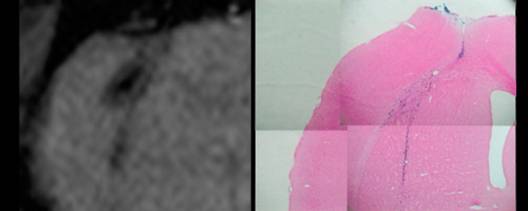 |
| 図3 ラット脳内のMR標識PC12細胞。 T2*-強調画像(200/30、45)(左)とPrussian Blueによる鉄染色(右)。標識PC12細胞は線条体へ移植し、61日後にMR画像を撮像した(左)。その後、脳組織を固定して鉄染色の後、写真(右)を得た。 |
このようにして調整した標識細胞を動物に移植し、MR画像による生体中からの検出を試みた。ここでは、標識PC12 細胞をラット脳の線条体へ移植した例を示している (図3)。この実験では、線条体に移植された細胞がT2*-強調画像により、3分程度のMR画像撮影時間で、画像コントラストから明瞭に識別される。さらに、この細胞の一部はおよそ9週間の間に、脳梁に沿って再分布していることが分かる。従ってHVJ-Eは比較検討した市販の遺伝子導入剤に比べ、きわめて効率よくMR標識剤を細胞内に移動させることができるため、生体内での標識細胞の部位を示すMRIの画像コントラストも顕著になり、標識細胞を長期にわたって継続的に観察することができるようになった。もちろん、本方法におけるHVJ-Eと造影剤の組み合わせでは、細胞に対する毒性も少なく、MR標識を施した後も、無標識の細胞と同様の増殖性を示し、また、脳組織の中でも細胞の機能を失うことはなかった。継続観察の最後に脳を固定して標本を作製し、鉄染色を行ったところ(図1、右図)、MR画像ときわめて良い一致を示した。このことからも、この常磁性標識が生体内での細胞の位置を正確に反映し、実験動物を犠牲にすることなく、長期間継続して移植細胞を観察できるようになった。
5.ES細胞の生体内追跡
マウスES細胞においても前述の細胞と同様にMR造影剤とHVJ-Eの組み合わせで、きわめて効率よくMRの常磁性標識が可能であった。実験ではマウスの神経幹細胞をレゾビストで標識し、事前にカイニン酸を投与しててんかんモデルを作成したマウス脳の海馬へ移植することにした。ちなみに、これらの細胞は標識後も、無処理の神経幹細胞と同様の増殖性を示したばかりか、ニューロンやグリアへの分化にもほとんど差異が認められなかった。このことから、培養の段階では常磁性鉄標識剤が神経幹細胞に対して毒性を持たないことを示唆する。
図4では、ラット脳の線条体に移植した標識神経幹細胞をMR画像法で長期間追跡した結果を示している。この場合、T1-強調で撮像しても、標識された幹細胞の位置が、T2*-強調画像と同様に低信号領域として観測される。解剖学的構造が良く分かるこの画像から、標識細胞の脳内での部位が正確に同定でき、標識細胞の分布がと周辺組織と関連して詳しく観察できるようになった。本図での最上段は、脳内への移植直後の標識細胞が線条体に位置していることを示している。しかし、13日後には移植部位からやや後方表層の皮質付近へ標識細胞が移動していることが認められた。このことは、細胞を移植した際の刺入創(外傷)に向かって神経幹細胞が移動したと考えられる。20日後、55日後と観察を続けると、コントストの強さは漸減するものの、同じ部位でMR標識が観察される。このことから、本標識法は移植細胞の部位を見極めるのみならず、脳内での移動をも経時的に追跡できることが明らかになった。
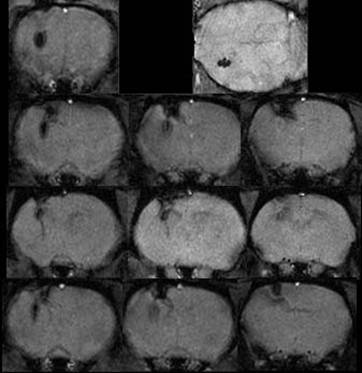 |
| 図4 ラット脳内の神経幹細胞の追跡。 1日後(最上段)、13日後(中上段)、20日後(中下段)、55日後(最下段)。本図の左側はラット脳の前方、右側は後方の断層画像を示す。 MR標識を施した神経幹細胞をラット線条体に移植した。移植直後のMR画像(最上段)では、神経幹細胞が線条体に移植されていることがわかる。13日目(中上段)では移植された線条体から、後上方の皮質へと移動している。この傾向は、20日目と55日目にも観測されている。 |
6.ミクログリアとアルツハイマー病
免疫に関連する細胞もMR画像を用いて追跡できる。例えば、脳内での防御をつかさどるミクログリアはアルツハイマー病の老人斑である集積したアミロイドを除去することに関係していると示唆されている。そこで、アルツハイマーのモデルを作成するために、βアミロイドをラット脳に投与し、その部位にミクログリアが集積するか調べた7)。
βアミロイドを投与した部位は図5のAのラット脳のMR画像の矢印の部位で、その反対側にはコントロールのために生理食塩水を投与した。この処置を施した3日後に、レゾビストで標識したミクログリアを静脈から導入し、その1日後にMR画像を撮像した(図5A)。この画像はラット脳のT2*−強調MR画像(水平断)を示す。この画像から、βアミロイドが投与された部位(矢印)に常磁性標識されたミクログリア(静脈から投与)が集積していることを示す。一方、生理食塩水が投与された反対側にはこのような集積は観察されなかった。このMR画像に対応する組織化学の画像とその拡大を図5BとCに示した。MR画像のコントラストに対応する部位に鉄粒子で標識されたミクログリアが集積していることが確認でき、MR画像と良い一致を見せる。図5の拡大図では、βアミロイドが高濃度に蓄積した部位(茶色)に標識したミクログリア(青色)が集積している。このミクログリアが実際にアミロイドを除去しているかどうかは不明ではあるが、少なくとも貪食作用を持つミクログリアが特異的に集積することがMR画像で確かめられた。ミクログリアの働きを利用してβアミロイド沈着を取り除くというアルツハイマー病の新しい治療戦略にも期待が持てそうである。
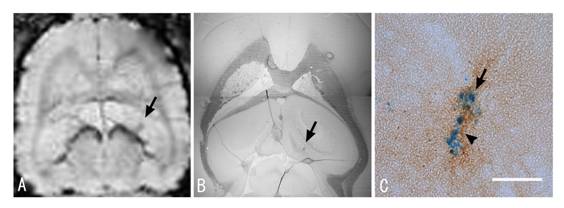 |
| 図5 アルツハイマー病モデルとミクログリア A.ラット脳のT2*−強調MR画像(水平断)、B.組織化学画像とC.その拡大図(スケール・バーは50μmを表す。) βアミロイドが投与された部位(矢印)に常磁性標識されたミクログリア(静脈から投与)が集積していることを示す。βアミロイドの反対側には生理食塩水がコントロールとして投与されている。B.はMR画像(A)に対応する組織画像でMR画像のコントラストが得られる部位に鉄粒子で標識されてミクログリアの集積が観察された。C.Bの拡大図でアミロイド(茶色)の沈着した部位にミクログリア(青色)が集積している。 |
7.MR以外の計測法との融合 − マルチ・モダリティー画像法
上述のように、細胞イメージングや細胞トラッキングに対してMR法には他の手法(モダリティー)には無い無侵襲性の長所が具わるが、逆に致命的な短所も併せ持つ。特に、分子イメージングとして重要な細胞の機能評価がPETや光イメージングでは容易であるのに対し、MRでははなはだ難しい。そこで、複数の計測手段を融合した計測法が考えられる。
近年、臨床画像診断の分野でPET(Positron Emission Tomography: 陽電子放射断層撮影装置)の普及が際立っている。ことに最近、X線CTと組み合わせたPET-CTが開発され、その普及にさらなる拍車がかかってきた。元々、FDGをはじめとする様々なPET試薬が開発され、腫瘍の検出や脳機能のような生理的情報の画像化に威力を見せる。しかしながら、PETはバックグラウンド(背景)となる人体の解剖画像が撮像できない。このため、X線CTによる解剖学的情報を加味することで、癌の有無やその正確な形状と体内での位置を一度に診断できるようになる。したがって、PET-CTのように二つの画像計測法を組み合わせることで、個々の手法では得られない卓越した生体画像情報を引き出すことが可能になる。
X線CTに比べ、MR画像法は軟部組織の描出能に優れ、PETで得られる分子情報を重ね合わせる解剖画像としてはより好ましい。こうした考えから、現在はPET-MRIの開発が海外で急ピッチに進められている。MR装置では強力な磁石を使用するため、PETの検出用管球を強力な磁界内に収める事が難しいが、英国ケンブリッジ大学ではMagnex社と協同してスプリット型の磁石を開発し、管球をはさみ込むことから、この問題の解決を図っている。また、PETとMRの2台の装置を並べて設置し、被験者を移動させて計測する組み合わせも報告されている。さらには、磁場内で動作するダイオード式のPET検出器(浜松フォトニクス)が試作され、ドイツのチュービンゲン大学では7テスラの動物用MR装置への組み込みが終わっている。また、この方式を採用する人体用のPET-MR装置(シーメンス社)の開発も始まっている。比較的早い時期に、臨床用PET-MRIが登場するかも知れない。すでにこのような装置の開発を見越して、PETとMRI兼用の分子イメージング用プローブの開発が始まっている。
一方、PETの装置に比べ、簡便に構成できる光学系の生体計測装置もMRIと組み合わせれば、それぞれの短所を補い合い、長所を生かすことができそうである。元々、分子生物学や細胞生物学の発展に寄与してきた顕微鏡下で観察するための様々な色素プローブは、その波長を可視光から近赤外へ伸ばすことで、マウスなどの小動物ではその体内からでも検出が可能になる。但し、生体内での光の散乱や吸収により、深部組織からの計測は難しく、しかも、画像の解像度にも難点がある。一例として、図6にラット脳で計測した近赤外蛍光画像のデータを示した。この弱点をMRの解剖画像で補えば、蛍光色素で表示される、細胞の機能や遺伝子発現など分子レベルの情報が、より精密になると期待される。
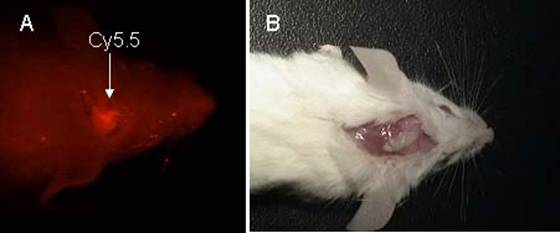 |
| 図6 ラット頭蓋骨に移植した直後の蛍光標識を持つ骨芽細胞。 A.標識剤として合成ペプチドにCy5.5(アマシャム)を担持させ、励起光:660nm、蛍光:700nmで計測した移植細胞。B.頭蓋骨を剥離後、標識細胞を移植し、ゲルで包埋したラット頭部の写真。 |
8.おわりに
これからの医療では、患者への負担を軽減するための無侵襲画像診断や低侵襲治療が主流になるであろう。この中で、患者さんの体の中の透視や、目には見えない化学物質あるいは生理・生化学的な情報の可視化技術はますます必要性が高まるであろう。しかし、今日の医療で用いられる放射線や放射性同位元素を含む画像診断やトレーサー技術は、大型の診断装置を用い、患者への肉体的な負担はもとより、結果的には社会・経済的負荷も必ずしも小さいとはいえない。これまでに述べてきたMR法の特徴から、今後の医療で予測される再生医療での遺伝子発現の画像化、あるいは、移植細胞、ことに万能細胞と呼ばれるES細胞の体内追跡など、新世紀の“患者に優しい”医療に貢献できる手法になるとを期待している。
本稿で解説した磁気的標識によるMR細胞追跡法が臨床に応用されるまでには、まだかなりの時間を要するかも知れない。しかし、今日用いられている細胞標識法の、蛍光色素や遺伝子標識を利用した方法は生体内での画像化が難しく、一方、核医学的手法にも侵襲性や画像解像度、あるいは、長期間の継続的な観察に問題が残る。この点、MR画像による細胞追跡法は、標識の無害化が達成されると、再生医療や細胞治療を推進する重要な画像法になると期待される。まさに、MR法は生体内での移植細胞の居場所を特定し、その機能が代謝画像で計測できる一石二鳥のポテンシャルを秘めている。
謝 辞
本稿で紹介した研究は、滋賀医科大学における「再生医療とMR医学研究会」の グループによって得られた共同研究の成果の一部である。ことに、神経幹細胞の研究に携わる、 遠山育夫教授(分神経科学研究センター)、鳥居隆三教授(動物生命科学研究センター), 鈴木文夫講師(脳神経外科学講座)、加藤雅也博士(石原産業、中央研究所)、近藤靖博士(田辺製薬、先端医学研究所)とその共同研究者に謝意を表します。なお、MR装置の活用では森川茂廣助教授と森田将史助手(MR医学総合研究センター)、ならびに、本論文の3次元MR画像の表示については、小森優教授(生命情報学)のご協力を得ました。心からお礼を申し上げます。
文 献
1) W.S. Enochs, P.G. Bhide, N. Nossiff et al. Exp Neuro 123: 235-242, 1993
2) J.M.W. Bulte, S.-C. Zhang, P. Gelderen et al. Proc Natl Acad Sci USA 96: 15256-15261, 1999
3) M. Hoehn, E. Kustemann, J. Blunk et al. Proc Natl Acad Sci USA 99: 16267-16272, 2002
4) M. Modo, M. Hoehn and J.W.M. Bulte Molec. Img. 4: 143-164, 2005
5) K. Toyoda, I. Tooyama, M. Kato, et al., Neuroreport. 15: 589-593, 2002
6) Y. Kancda, T. Nakajima, T. Nishikawa et al. Molec Therapy 6: 219-226, 2002
7) Y. Song1, S.Morikawa, M. Morita, T. Inubushi, et al., Histol Histopathol 395: 42-45, 2006
Correspondence: 滋賀医科大学MR医学総合研究センター 犬伏 俊郎 〒520-2192 大津市瀬田月輪町