Research Project
私たちは、細胞がどのようにしてがん化し悪性化するのか、また免疫細胞がどのようにしてがん細胞を殺傷するのかを明らかにし、免疫細胞を利用したがん免疫療法を開発する研究を行っています。 現在、主に以下の4つのプロジェクトを進めています。これらのプロジェクトに加わっていただける助教、あるいは特任助教1名と、大学院生(奨学金給付)を募集しています。(詳しくはRecruitmentを御覧下さい。)御興味のある方は、お気軽に縣まで御連絡下さい。 (yagata @ belle.shiga-med.ac.jp @前後のスペースを除いて下さい)
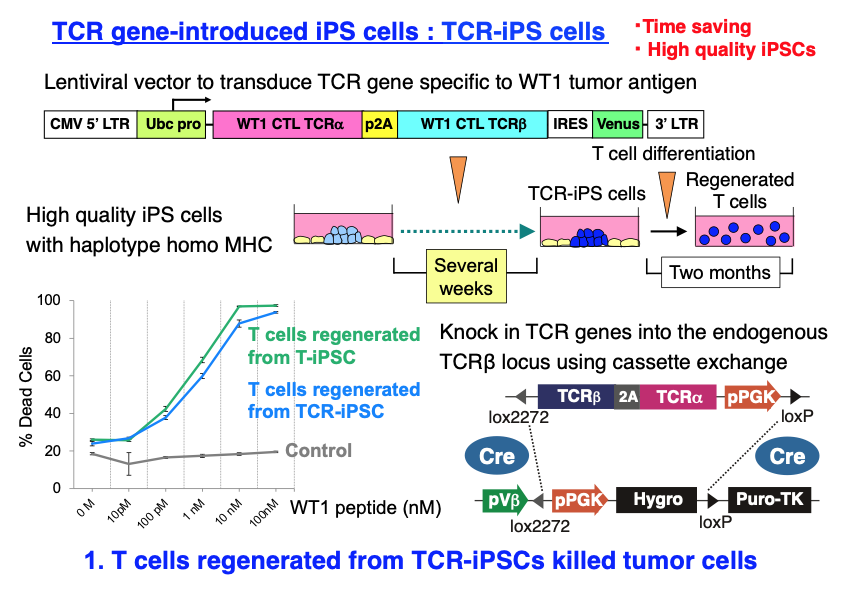
1) ゲノム編集とカセット交換法を用いてiPS 細胞からがん細胞を殺傷できるT細胞を効率よく再生する方法の開発
従来のがん免疫細胞療法では、患者さんのT細胞をがん抗原で刺激しても十分に増やすことができないことが多く、その効果は限定的でした。 この問題を解決するために、京都大学の河本 宏教授の研究室では、がん抗原特異的なT細胞からiPS細胞を作製し (T-iPS細胞) 大量培養したのち、T細胞へ分化誘導することにより、活性の高いがん抗原特異的なT細胞を再生することに成功しました (Cell Stem Cell 12: 31, 2013)。 私たちは、河本教授と共同研究を行い、がん抗原特異的なT細胞受容体(TCR)遺伝子を、レンチウイルスを用いてiPS細胞に直接導入し、得られたTCR-iPS細胞をT細胞へ分化誘導することで、がん抗原特異的に腫瘍細胞を殺傷できるT細胞を効率よく、かつ迅速に再生することに成功しました。
さらにTCRの発現レベルを高めるとともに、がん化の原因となりうるベクターのランダムな組込みを回避するために、ゲノム編集とカセット交換法を用いてTCR遺伝子を内在性のTCRβ遺伝子座に効率的にノックインすることができる新しい方法を開発しました (特許取得済)。これらのプロジェクトは、河本先生が代表で令和元年度から採択されたAMED先端的バイオ創薬等基盤技術開発事業「超汎用性即納型T細胞製剤の開発」の分担研究です。
Maeda T, Nagano S, Kashima S, Terada K, Agata Y, Ichise H, Ohtaka M, Nakanishi M, Fujiki F, Sugiyama H, Kitawaki T, Kadowaki N, Takaori-Kondo A, Masuda K, Kawamoto H.* Regeneration of tumor antigen-specific cytotoxic T lymphocytes from iPSCs transduced with exogenous TCR genes. Molecular Therapy - Methods & Clinical Development, 19:250-260, 2020.
Kashima S, Maeda T, Masuda K, Nagano S, Inoue T, Takeda M, Kono Y, Kobayashi T, Saito S, Higuchi T, Ichise H, Kobayashi Y, Iwaisako K, Terada K, Agata Y, Nakamura K, Saito M, Narita S, Ogawa O, Habuchi T, Kawamoto H. Cytotoxic T lymphocytes regenerated from iPS cells have therapeutic efficacy in a patient-derived xenograft solid tumor model. iScience 23(4): 100998, 2020
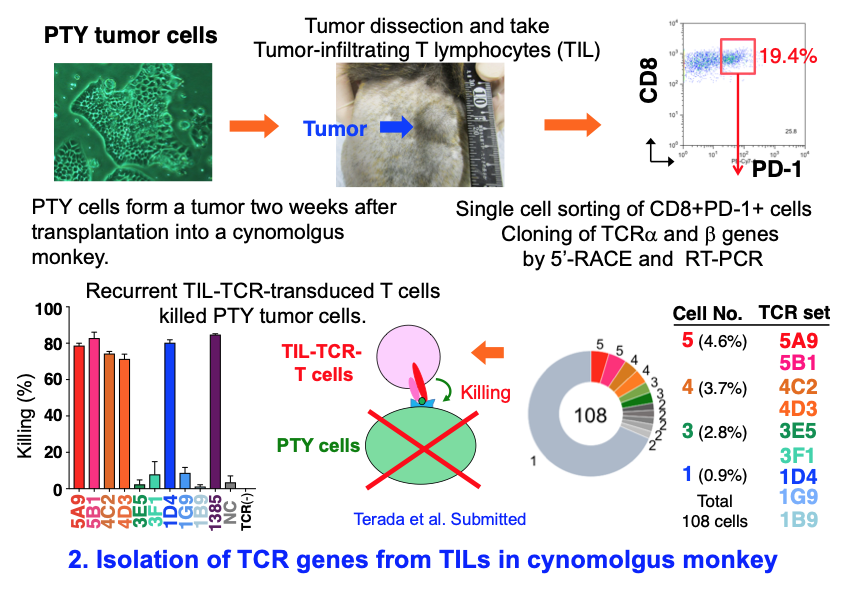
2) カニクイザルの腫瘍に浸潤したT細胞から腫瘍細胞を殺傷できるTCR遺伝子を同定する
がん免疫療法の有効性を評価するためには動物モデルが必要ですが、マウスとヒトの免疫系には大きな違いがあり、マウスの腫瘍モデルで得られた結果を臨床に応用できないことが多いことから、非ヒト霊長類の動物モデルが必要です。そこで我々は、カニクイザルの腫瘍細胞を、MHCが一致したサルに移植するカニクイザルのがん細胞移植モデルを用いて実験を行っています。 移植した腫瘍に浸潤したT細胞からTCR遺伝子をクローニングし、高頻度に見出されたTCR遺伝子を、iPS細胞から再生したT細胞に導入したところ、腫瘍細胞を殺傷することができるTCR遺伝子を同定することに成功しました。
Terada K, Kondo K, Agata Y, et al. Submitted
Satooka H, Ishigaki H, Todo K, Terada K, Agata Y, Itoh Y, Ogasawara K, Hirata T. Characterization of tumour-infiltrating lymphocytes in a tumour rejection cynomolgus macaque model. Sci Rep. 10(1):8414, 2020
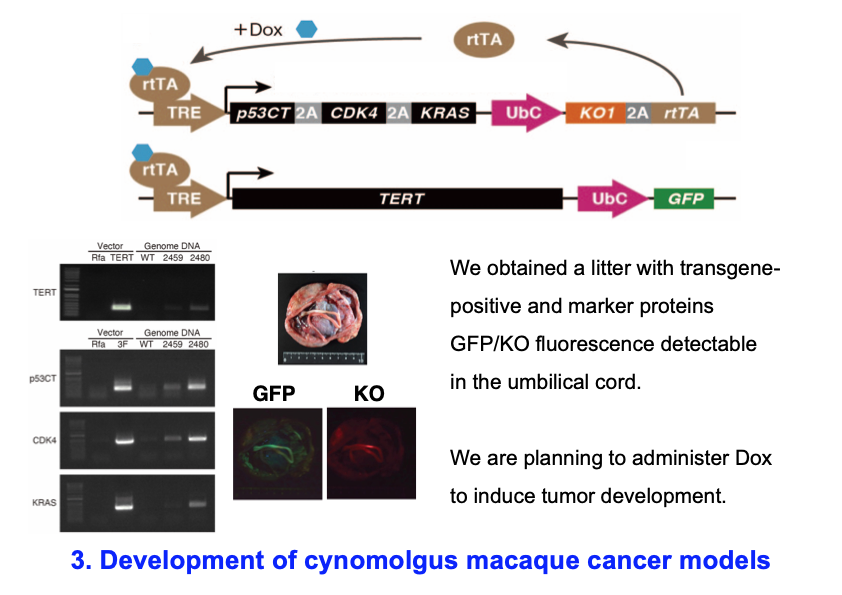
3) がん誘導性遺伝子を薬剤誘導的に発現するカニクイザルのがんモデル作出
マウスとヒトでは、免疫系における違いに加えて、細胞のがん化のメカニズムにも違いがあります。例えば、マウスではp53のようながん抑制遺伝子の不活性化と、Krasのようながん遺伝子の活性化によって腫瘍が発生することが多くのマウス腫瘍モデルでわかっています。それに対して霊長類では、正常な細胞をがん化させるためには、少なくとも4つの、がんを誘導する遺伝子の強制発現が必要です。そこで私たちは、これら4つのがん誘導性遺伝子を、ドキシサイクリンという薬剤によって誘導的に発現させることができるトランスジェニックカニクイザルの作出に取り組んできました。現在までにトランスジーン陽性で、マーカーの蛍光タンパク質の発現が検出できた産仔を得ることに成功しています。このトランスジェニックサルにおいて、ドキシサイクリンの投与によってがんを発症させることができれば、世界初のサルのがんモデルとなります。
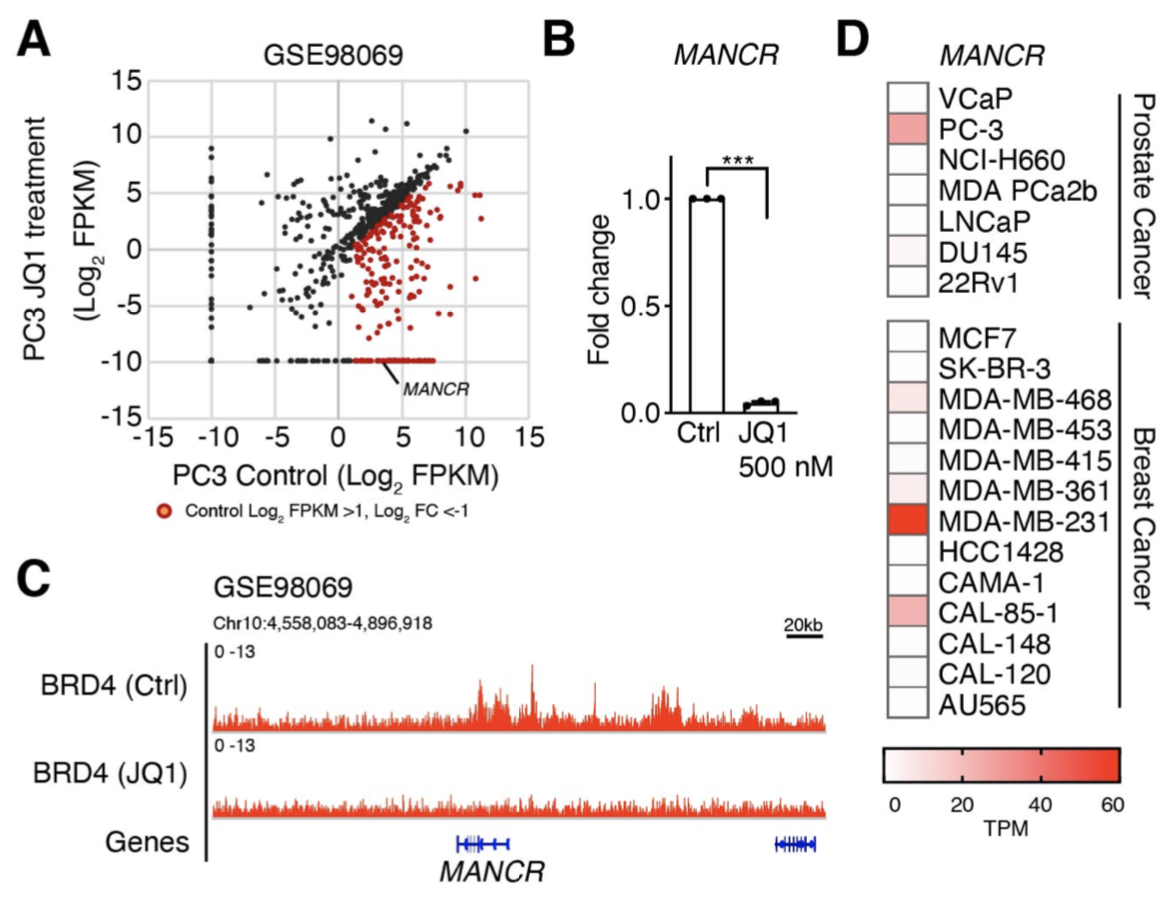
4) がん細胞の悪性化における Super-Enhancer の機能解明
がん細胞では、がん化を促進する遺伝子において、super-enhancer (SE)と呼ばれるエンハンサーのクラスターが形成されることで、高度な発現がおこります。Bromodomain and extra terminal domain (BET) タンパク質の1つであるBRD4 は、多くのがん種において、がん遺伝子の SEに結合し高発現を誘導します。BETタンパク質阻害剤であるJQ1は、がん細胞の悪性化を抑制することが報告されてきましたが、JQ1の標的遺伝子の大部分は明らかではありませんでした。私たちは、悪性度の高い前立腺がん細胞において、JQ1によって顕著に発現が抑制される遺伝子として、MANCRというlong non-coding RNAを同定しました。さらにBRD4がMANCR遺伝子領域に結合し、JQ1によってその結合が阻害されることに加えて、MANCRががん細胞の遊走や浸潤に重要な役割をはたすことを明らかにしました。
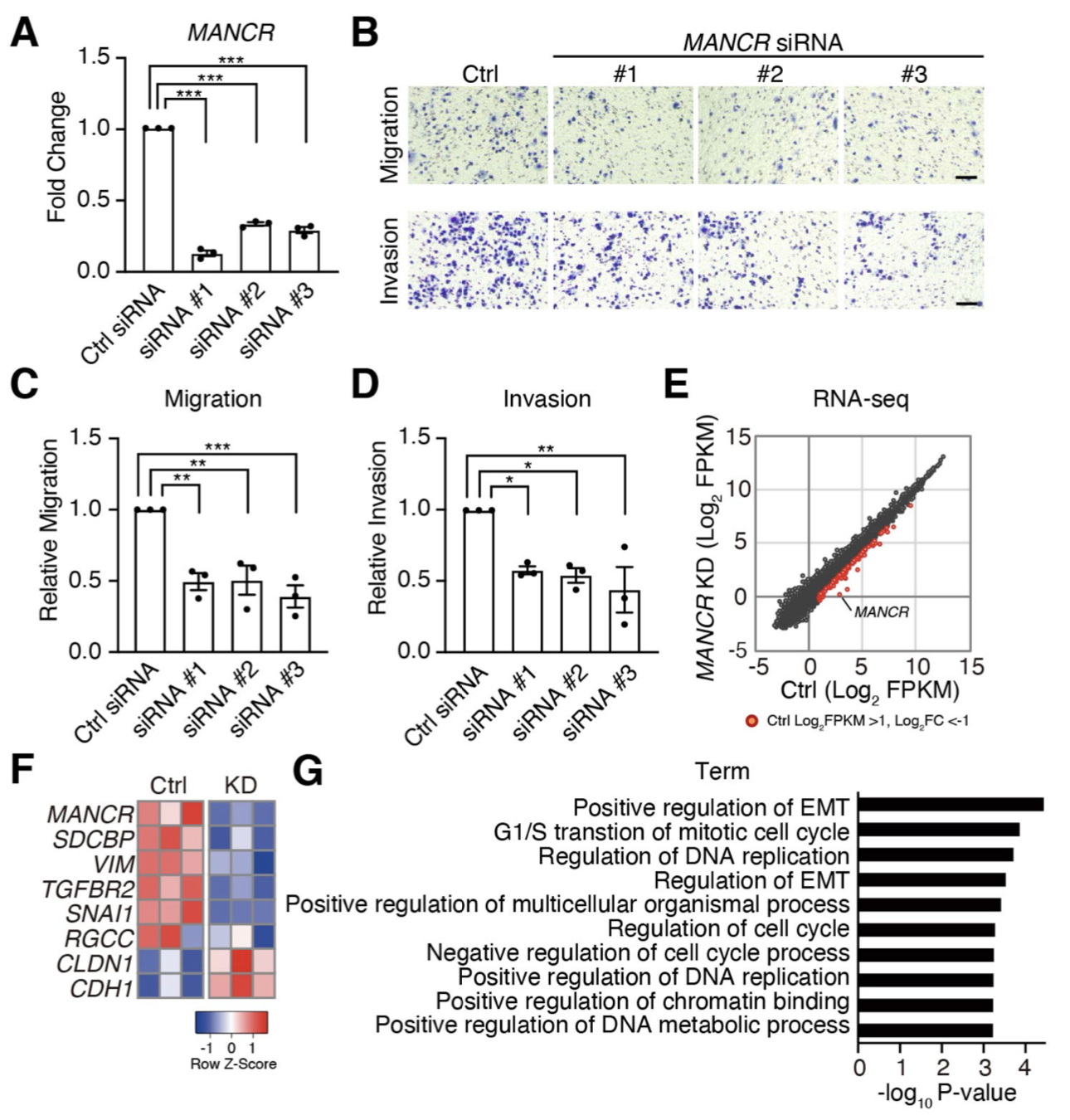
Nagasawa M, Tomimatsu K, Terada K, Kondo K, Miyazaki K, Miyazaki M, Motooka D, Okuzaki D, Yoshida T, Kageyama S, Kawamoto H, Kawauchi A, Agata Y. Long non-coding RNA MANCR is a target of BET bromodomain protein BRD4 and plays a critical role in cellular migration and invasion abilities of prostate cancer. Biochem Biophys Res Commun. 526, 128-134, 2020

with Drs. Tasuku Honjo and Yasumasa Ishida