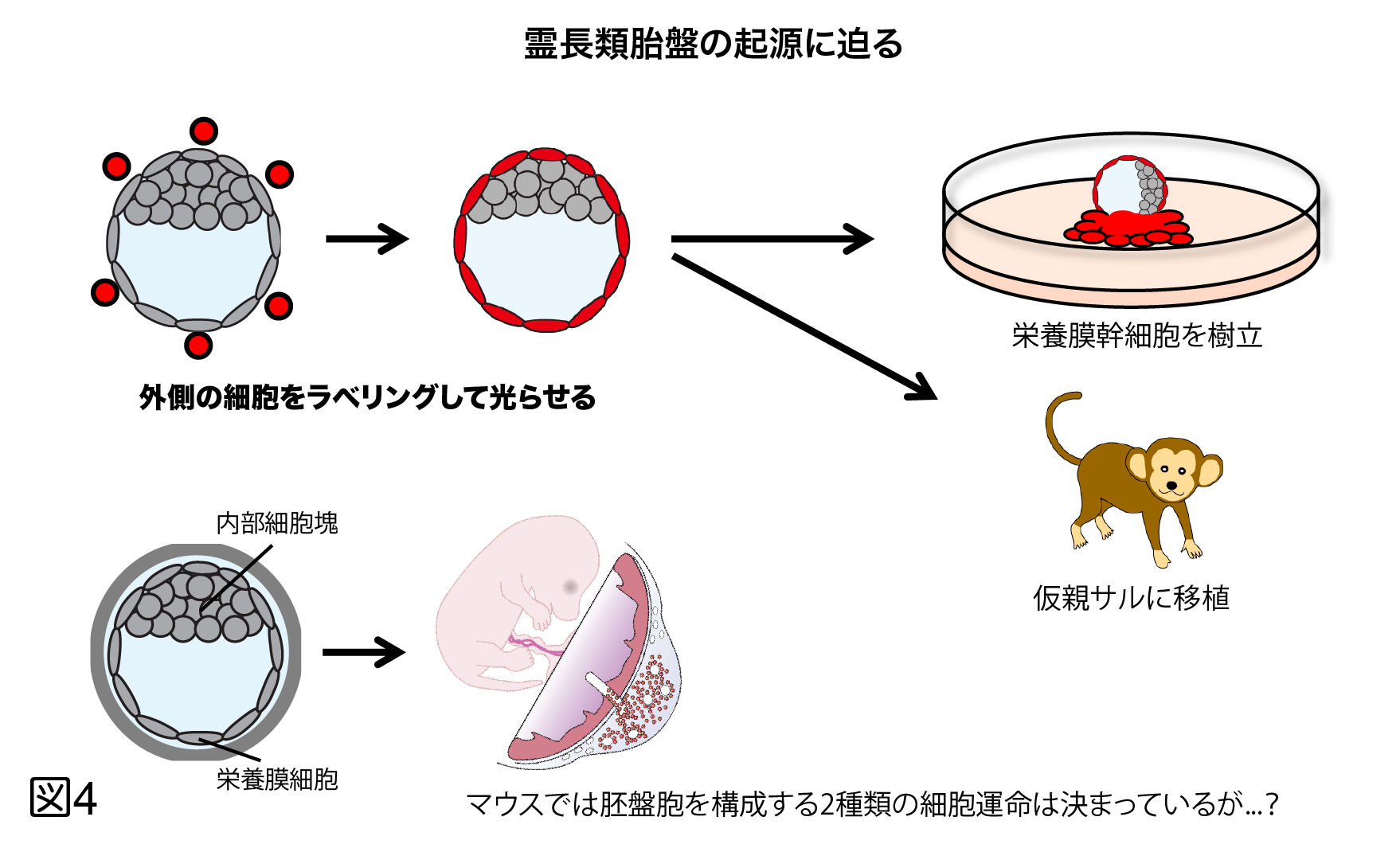
げっ歯類は解剖学的・生理学的にヒトに類似していることや、トランスジェニックおよびゲノム編集技術を用いた遺伝子改変技術と相性が良く、多くの有用なヒト疾患モデルマウスが作出されてきた。一方で、マウスとヒトには相当数の遺伝的な差が認識されており、オルソログと考えられる遺伝子でも、発現する組織が異なることもあり、機能的同一性が不明な遺伝子も多い。またパーキンソン病のようにモデルマウスがヒトと同じ病態を示さない事例が多く報告されるようになっている。このようなことから、よりヒトに近い実験動物である非ヒト霊長類における遺伝子改変疾患モデル動物の開発が待たれていた。
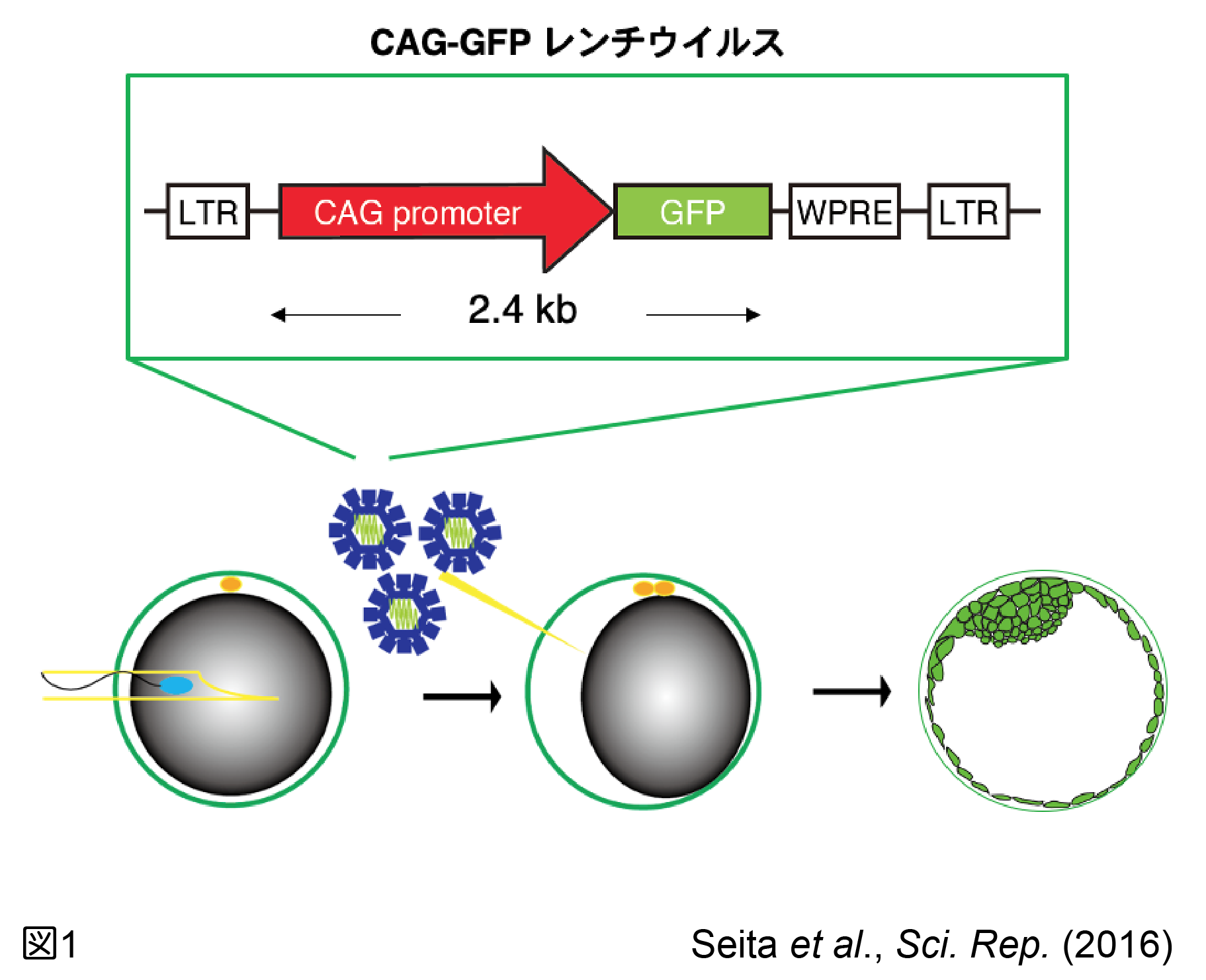
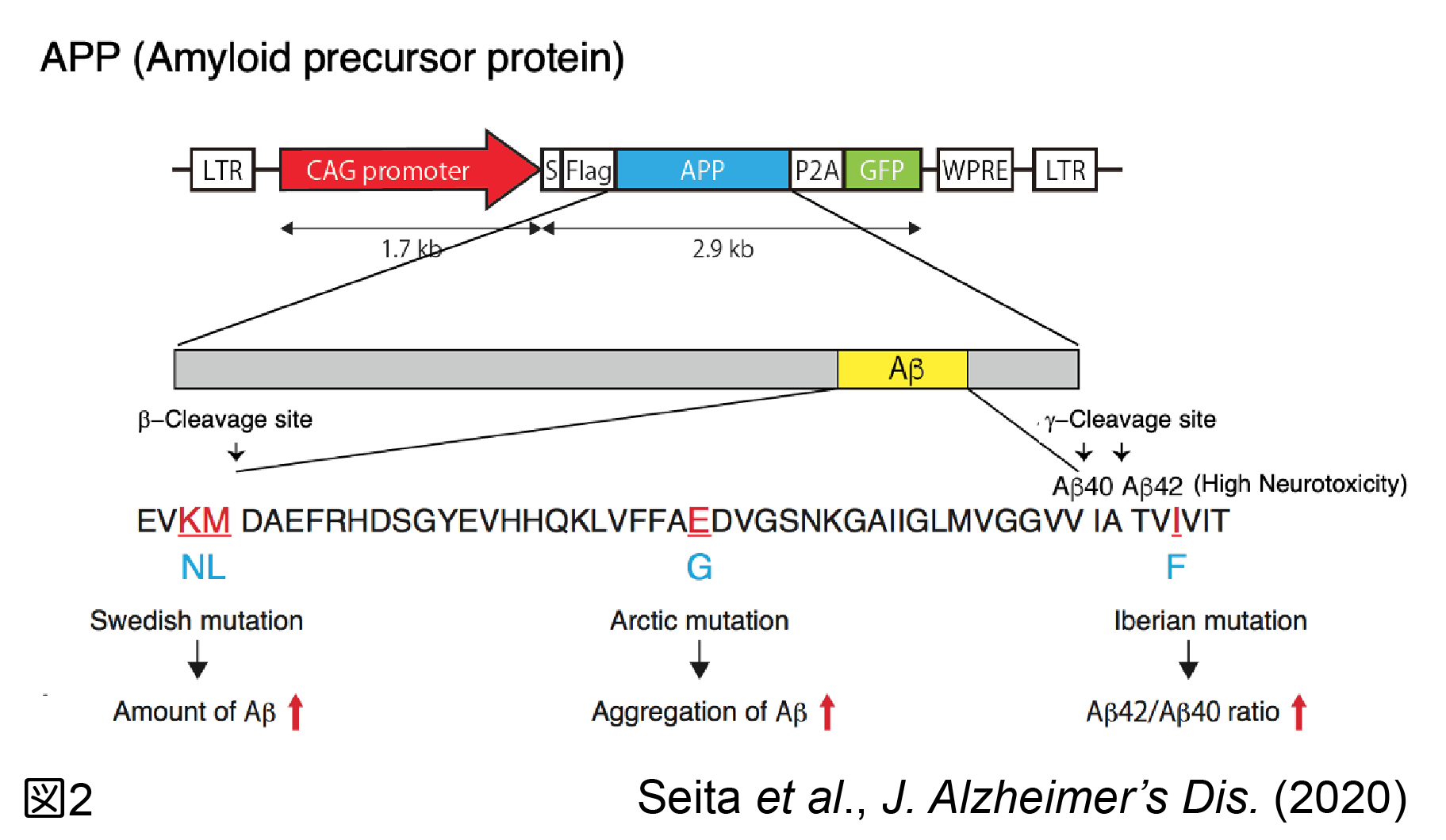
我々は非ヒト霊長類の一種であるカニクイザルにおいて遺伝子改変系を立ち上げるために、先ずレンチウイルスベクターを用いて全身性にGFPを発現するトランスジェニックカニクイザルを作製する技術を確立した(Seita et al., 2016, 2019; 図1)。次に認知症をカニクイザルにおいて再現するために、家族性アルツハイマー型認知症で認められるSwedish、Arctic、Iberian 変異を導入したアミロイドβ前駆体タンパク質を発現するトランスジェニックカニクイザルを作製した(Seita et al., 2020; 図2)。今後、ヒトのアルツハイマー病と同様に、老人斑の出現から神経原繊維化の形成、神経細胞死へ進展し、認知症を発症するかどうかをこのモデルで確認する必要があるが、確認されればヒトのアルツハイマー病の進展機構を再現する世界初の動物モデルを得られたことになり、アルツハイマー病の発症メカニズムを解明し、治療法の開発に役立つことが期待される。
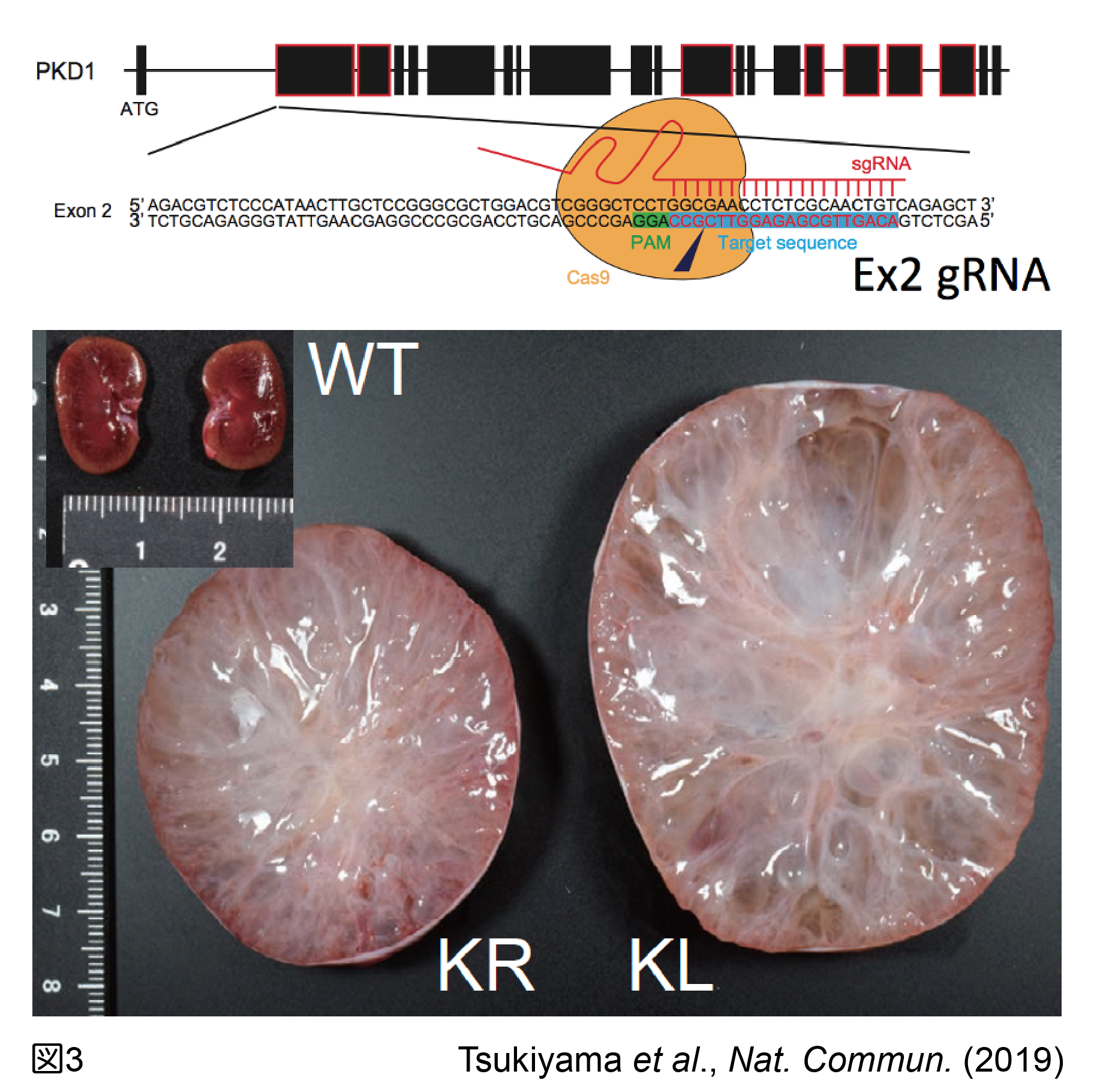
一方、2012年に報告されたCRISPR/Cas9によって、受精卵ゲノムを直接遺伝子操作することでノックアウト(KO)動物を簡便に作出する事が可能となった。ヒト指定難病の一つである常染色体性多発性嚢胞腎(ADPKDとも呼ばれる)は、PKD1遺伝子をヘテロ欠損すると発症し、両側腎臓に多数の嚢胞が進行性に発生・増大する最も頻度の高い遺伝性嚢胞性腎疾患である。これまでのマウスを用いた研究から、Pkd1をヘテロ欠損させても殆ど嚢胞が発生しないため、Pkd1両側アリルへのヌル変異の導入によって嚢胞を発生させるモデルが使われてきた。我々は、カニクイザルPKD1エクソン4に1塩基多型が産地によって存在することを見出し、父親側のみ認識するgRNAを設計、父親アリルのみを効率的に切断することで、選択的にPKD1ヘテロ体を作出することに成功した(Tsukiyama et al., 2019; 図3)。得られたPKD1ヘテロ体の両側の腎に嚢胞の発生を認めるとともに、主として皮質に多発すること、遠位尿細管由来であることが示された。このような遺伝子改変カニクイザルを用いた疾患研究から、霊長類特有の嚢胞発生機序が判明し、根本的な治療法の開発に繋がっていくことが期待される。