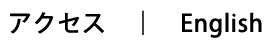本来、免疫とは、体内に侵入してきた病原体を排除して体を守るためのものです。しかし、私たちは、自身の細胞や組織に過剰に反応して攻撃を加えてしまうことにより「自己免疫疾患」になったり、外界の物質に対して過剰に反応してしまうことにより「アレルギー疾患」になったりします。わが国ではこれらの疾患が増え続けており、21世紀に克服すべき重要疾患として位置づけられています。しかし、その治療法は未だ確立していません。
免疫系が他の器官系と大きく異なる点は、その構成細胞が1つの組織に固定して存在するのではなく、体の中を1つの組織から別の組織へと動きまわっているということです。免疫系の細胞の多くは、動いて始めてその機能を果たすことができ、免疫応答が可能になるのです。私たちの研究室では、免疫系の細胞動態に注目し、「生体内で免疫細胞がどのようなメカニズムで動くのか?」「アレルギーや自己免疫疾患では免疫細胞の動きがどのように変化するのか?」「動きを調節することによって免疫応答をどのように制御するか?」といった観点から研究を進めています。免疫学研究、炎症・免疫疾患の病態解明、治療法の開発に興味のある方に是非私たちの研究に参加していただきたいと思います。
1.免疫細胞の生体内移動機構
上にも述べたように、免疫細胞は体の中を動きまわっていますが、その移動パターンは細胞の種類によって異なります。たとえば、抗原刺激を受けていないリンパ球は、血管からリンパ節やパイエル板などのリンパ組織に流入しますが、やがてまた血管内に戻り、全身を循環します。一方、抗原刺激を受けたリンパ球は皮膚や粘膜などの末梢組織に行くようになり、そこで免疫反応を引き起こします。このようにリンパ球は刺激を受けると行き先を変えるようになるのですが、私たちは、どのような機構で行き先を変えるのかという問題に焦点を当てて研究を進めています。特に、免疫細胞が皮膚や粘膜にどのようにして行くようになるのかについて、接着分子やケモカインの役割に着目して解析しています。皮膚と粘膜は体外から侵入しようとする病原体に対して最初のバリアーとして機能する場所ですので、リンパ球が速やかに動員されることが感染防御において非常に重要です。一方、皮膚や粘膜に浸潤するリンパ球はアトピー性皮膚炎などの炎症性皮膚疾患、花粉症などのアレルギー、クローン病や潰瘍性大腸炎などの炎症性腸疾患の病因・病態にも関与することが知られています。皮膚や粘膜へ免疫細胞が動員される分子機構の理解に基づいて、動員のプロセスを標的としたアレルギー・自己免疫疾患の有効な治療法を開発していきたいと思います。
参考論文: J Immunol 178, 2499-2506, 2007
2.細胞骨格関連分子による免疫応答制御
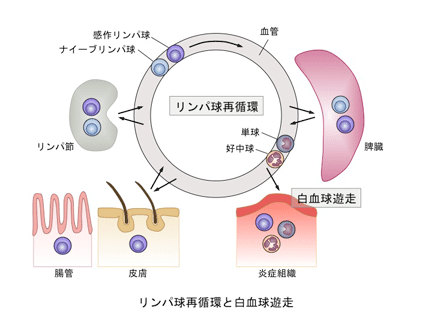
細胞が動くためには細胞骨格が重要な役割を果たすことはいうまでもありません。特にアクチンフィラメントは細胞皮層に張り巡らされ、細胞形態の維持や細胞のさまざまな運動に関与することが知られています。私たちは、細胞表面分子を細胞皮層のアクチンに連結する分子であるERMタンパク質の1つであるmoesinを欠損するマウスでは、さまざまな免疫細胞の動態に異常があることを見いだしました。このマウスでは、末梢血中のT細胞やB細胞が減少し、これが胸腺や骨髄からの移出の障害によることを明らかにしました。このマウスでは免疫応答にもさまざまな異常があることがわかってきています。細胞の動きと免疫応答との関連をさらに解析し、動きを調節することによりどのように免疫応答を制御できるのか解析しています。
参考論文: Int Immunol 24, 705-717, 2012
3.免疫系におけるGPCRシグナリング
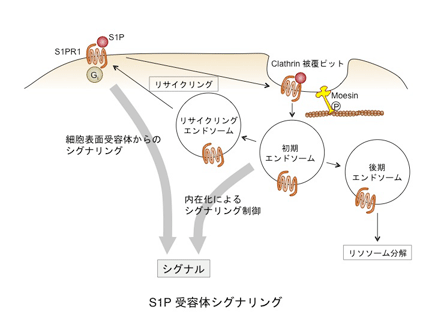
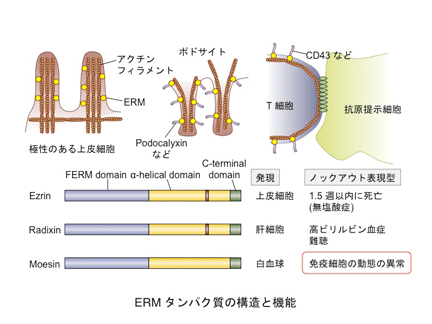
免疫細胞の行き先を決めるのは、1つは接着分子です。細胞にどのような接着分子が発現し、どのようにその活性が調節されるか、そして行き先で相手分子の発現や活性がどのように調節されるかによって、細胞は特定の場所に行くことができます。細胞の行き先を決めるもう1つの重要な分子は、ケモカインや脂質メディエーターなどの細胞を引き寄せる分子です。これらの誘引物質は受容体に結合することによってそのシグナルを細胞内に伝えます。これらの誘引物質の受容体はGタンパク質共役型受容体(GPCR)とよばれるファミリーに属し、細胞膜を7回貫通し、三量体Gタンパク質を介してシグナルを伝達します。近年、このGPCRを介するシグナル伝達に、受容体の細胞内での局在変化などの動態が関与することがわかってきました。GPCRの多くはリガンドが結合すると細胞内に内在化され、それによってシグナル伝達が制御されています。免疫系では、このような受容体の動きが、免疫細胞の機能や動態に大きく関わることがわかってきました。特に、リンパ球のリンパ臓器からの移出に関わる脂質メディエーターであるスフィンゴシン1リン酸(S1P)の受容体は、内在化によりその機能が厳密に調節されています。私たちは、研究プロジェクト2で述べたERMタンパク質のmoesinがその内在化に関わることを見いだしました。このような免疫系ではたらくGPCRの内在化の機構やシグナリングの制御機構について研究を行っています。