機関長の許可手続き(外部審査委員会、試料・情報の提供)
■他機関の認定臨床研究審査委員会(法)
一括審査について
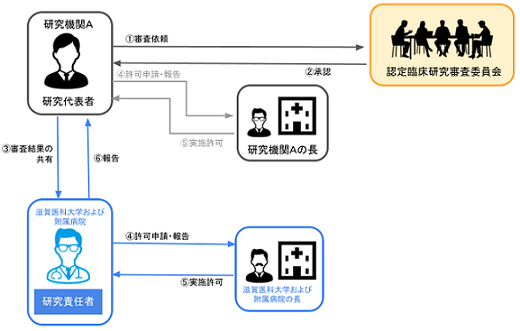
臨床研究法では、特定臨床研究を多施設共同研究として実施する場合にあっては、統括管理者が一括して認定臨床研究審査委員会で審査を受ける必要があります。
統括管理者が手続きを一括して行うことにより、それぞれの実施医療機関が個別に審査を受ける必要はありません。
研究責任医師は認定臨床研究審査委員会の承認後、研究実施の可否について実施医療機関の管理者に承認を得る必要があります。
審査書類の作成と提出
統括管理者より審査に必要な書式作成の依頼がありましたら、その依頼に則り書式を作成し、提出してください。
①研究責任医師及び研究分担者リスト(統一書式1)
②利益相反確認書類
③実施医療機関の要件 各施設確認シート(参考書式2)
④履歴書(参考書式4)
⑤その他、認定臨床研究審査委員会が求める文書
認定臨床研究審査委員会で審査
統括管理者が認定臨床研究審査委員会に付議し、一括審査が行われます。
新規許可の取得
<必要書類>
統括管理者から下記資料を入手してください。
①認定臨床研究審査委員会に申請した資料一式
※他機関の研究者等リスト、他機関の利益相反確認書類(様式E)は不要
②審査結果通知書(統一書式4)
③本学固有の事項(研究責任者名、相談窓口など)を記載した同意説明文書
④(ある場合)jRCT公開資料(様式第1実施計画)
<手順>
1.申請フォームより必要書類を提出してください。
2.実施許可書(新規)を受領し、統括管理者に提出してください。
3.統括管理者に許可書を提出し、統括管理者から臨床研究等提出・
公開システム(jRCT)に登録(公開)した情報を入手してから、
研究を開始してください。

機関の長の許可・報告に関する
お問い合わせ先
お問合せはこちらから
臨床研究開発センター
臨床研究管理部門
E-mail:kyokadri@belle.shiga-med.ac.jp
TEL:077-548-3618