本研究室の代表的な論文を紹介します。
- 非ヒト霊長類モデルにおけるH5N6高病原性鳥インフルエンザウイルスに対するノイラミニダーゼ阻害薬の有効性(2020年)
- カニクイザルにおけるSARS-CoV-2に対する中和抗体依存性と非依存性免疫反応(2021年)
- カニクイザルでは主要組織適合抗原複合体一致他家iPS細胞を移植してもteratomaは形成されない(2021年)
- iPS細胞から誘導した癌細胞のMHCの一致したカニクイザルへの移植は、カニクイザル血漿中に抗GRP94抗体の産生を誘導する。(2017年)
- 霊長類モデルでのH7N9インフルエンザウイルスに対するワクチンとノイラミニダーゼ阻害薬の効果(2015年)
- 抗H5ヘマグルチニン抗体(ヒト化キメラ抗体)は高病原性鳥インフルエンザウイルス感染の治療薬として働く(2014年)
- カニクイザルを用いた不活化H5N1全粒子ワクチンのH5N1高病原性鳥インフルエンザおよびパンデミックH1N1インフルエンザウイルスに対する防御効果(2013年)
- 免疫低下カニクイザルにおけるパンデミックH1N1亜型インフルエンザウイルスの病原性(2013年)
- 不活化全粒子ワクチンはパンデミックH1N1インフルエンザウイルスに対する免疫記憶を誘導するーMafa-A1*052:02をもつカニクイザルを用いた実験(2012年)
- カニクイザルを用いたH7N7亜型高病原性鳥インフルエンザウイルスに対するワクチンの開発(2010年)
- パンデミック(H1N1)2009インフルエンザウイルスの性状(2009年)
霊長類モデルにおけるH5N6高病原性鳥インフルエンザウイルスに対するノイラミニダーゼ阻害薬の有効性
Efficacy of neuraminidase inhibitors against H5N6 highly pathogenic avian influenza virus in a non-human primate model.
Antimicrob Agents Chemother 64, e02561-19, 2020. Doi: 10.1128/AAC.02561-19
季節性インフルエンザ(N1とN2)と異なるノイラミニダーゼをもつH5N6高病原性鳥インフルエンザウイルスは2013年に初めて発見され、中国では鳥からヒトに感染し、重症肺炎を起こすことが報告さています。この亜型のウイルスは、人では高い致死率を示します。また、多くの国で家禽と野鳥に検出され、世界的に鳥から人への感染が懸念されています。さらに人類では流行したことがないため、人はH5N6亜型ウイルスに対して免疫を有さず、ヒトの間に感染するような変異を獲得した場合に大流行となる可能性があります。H5N6亜型のウイルスに対して、現在使用可能な抗ウイルス薬が効くのかがまだ明らかではありません。そこで私たちは人間に遺伝的に近いカニクイザルに日本で黒鳥から分離されたウイルスを感染させ、ウイルスの病原性と抗ウイルス薬の有効性について研究しました。
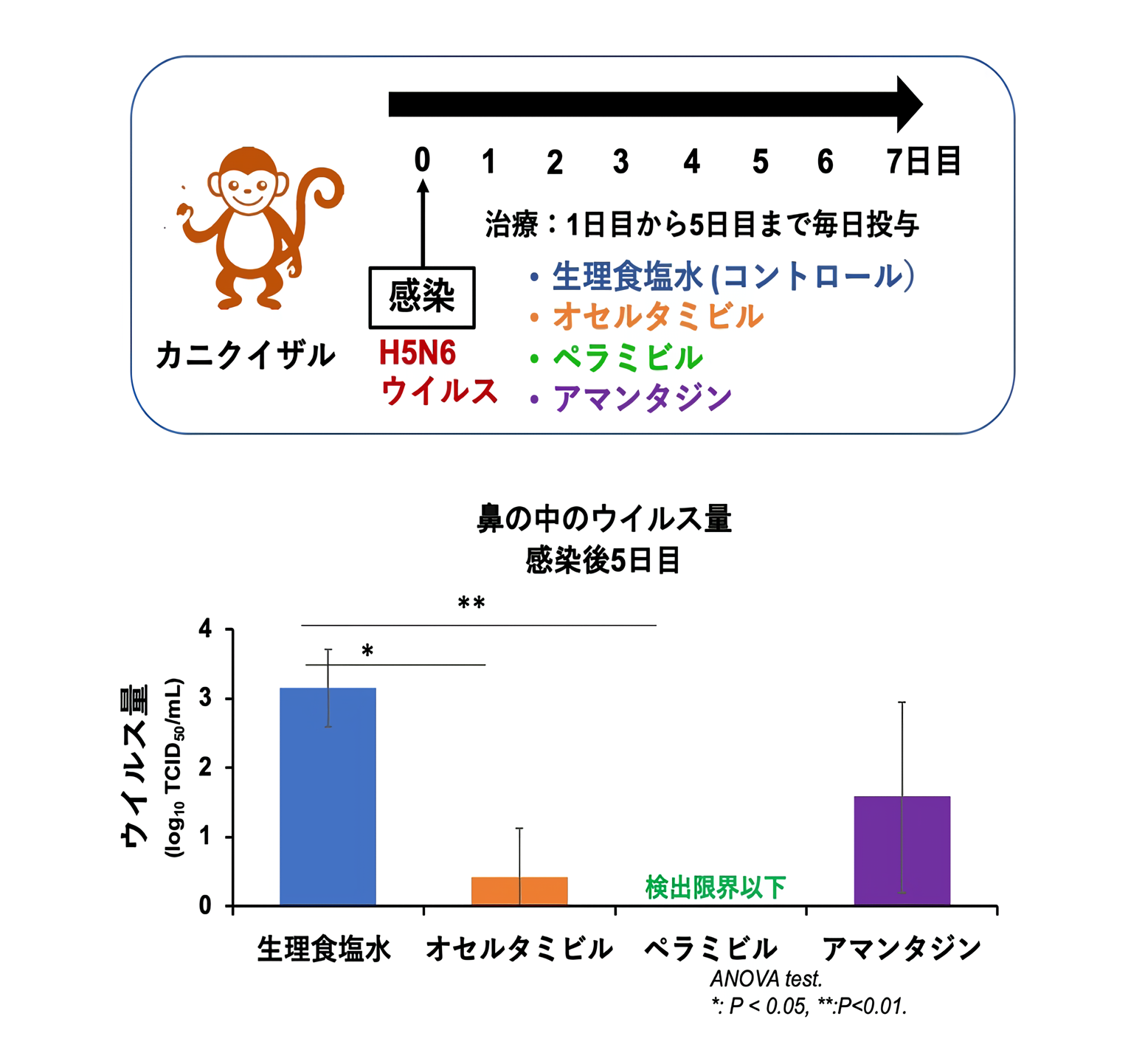
実験ではサルにH5N6ウイルスを感染させて、翌日から感染後5日目まで毎日生理食塩水、オセルタミビル、ペラミビル、アマンタジンを投与しました(上図)。
結果
投薬治療群では、鼻内のウイルス量が生理食塩水群と比べて低く、 3種の薬にウイルスを抑制する効果があると考えられました。オセルタミビルとペラミビルの治療グループではウイルスが早くに検出されなくなりましたが、アマンタジン治療群ではウイルスが検出され、効果が低いことが分かります(下図)。
結論
H5N6ウイルスに対して、既存のノイラミニダーゼ阻害薬(オセルタミビルとペラミビル)が有効であることが確認されました。2020年から2021年にはH5N8亜型ウイルスが日本国内だけではなく、世界中の鳥類で確認されているので、季節性インフルエンザウイルスと異なるノイラミニダーゼをもつウイルスに対する治療薬の研究を継続する必要があると考えられます。
カニクイザルにおけるSARS-CoV-2に対する中和抗体依存性と非依存性免疫反応
Neutralizing antibody-dependent and -independent immune responses against SARS-CoV-2 in cynomolgus macaques.
Virology 554, 97-105, 2021. DOI: 10.1016/j.virol.2020.12.013
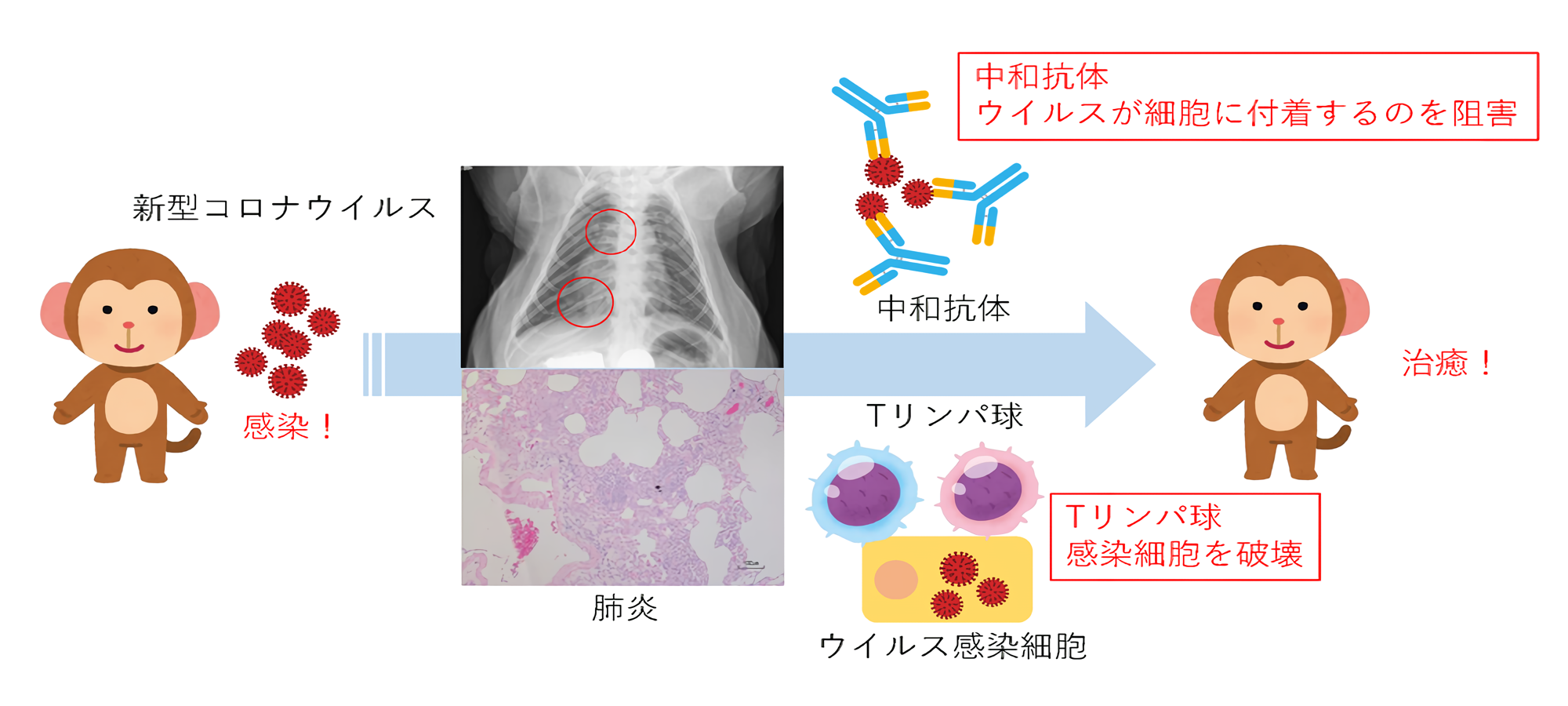
新型コロナウイルスの感染が全世界に広がっており、死者や重症者が多数報告され、対策が喫緊の課題です。ワクチンや治療薬の開発では、動物を使わない研究だけでは副作用や生体反応の予測が困難であるため、動物を使い有効性と安全性を確かめる必要があります。そのため、このウイルスが感染し、患者と似た症状を示す動物を使うことが適切と考えられます。そこで、新型コロナウイルスを3頭のカニクイザルに感染させ、症状や免疫反応を解析しました。ウイルスに感染した翌日には、サルは発熱し、3頭中1頭ではX線検査で肺炎が確認されました。また、感染力をもつウイルスが感染から7日目まで鼻腔や口腔などに検出されました。感染10日目には、ウイルスに結合し、感染を防御する免疫タンパク質である中和抗体が1頭のサルに検出され、感染から治癒したと考えられました。他の2頭のサルでは、中和抗体の産生はみられませんが、ウイルスに反応するTリンパ球が増加しました。このように新型コロナウイルスに対しては、中和抗体だけでなく、Tリンパ球もウイルスの排除に関与すると考えられ、今後のワクチンの有効性に期待が持てる結果となりました。また、3頭とも感染から28日までに重症化することはなく、治癒したと考えられます。8割の感染者は軽症から中等症であることから、カニクイザルにおいても同様の症状であったと考えられます。
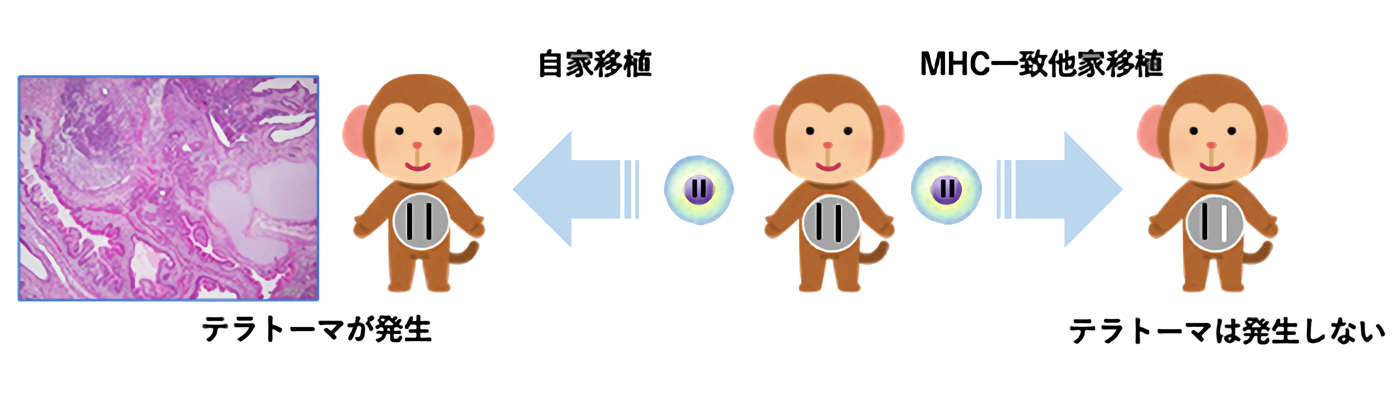
カニクイザルでは主要組織適合抗原複合体一致他家iPS細胞を移植してもteratomaは形成されない
No Tumorigenicity of Allogeneic Induced Pluripotent Stem Cells in Major Histocompatibility Complex-matched Cynomolgus Macaques.
Cell Transplant 30, 963689721992066, 2021. doi: 10.1177/0963689721992066.
Induced pluripotent stem cells(iPS細胞)を用いた細胞治療において、iPS細胞が未分化細胞であるために、移植した細胞から腫瘍が発生することが懸念されています。また、アカゲザルに自己のiPS細胞を移植したとき、奇形腫(テラトーマ、teratoma)の発生が確認されています。
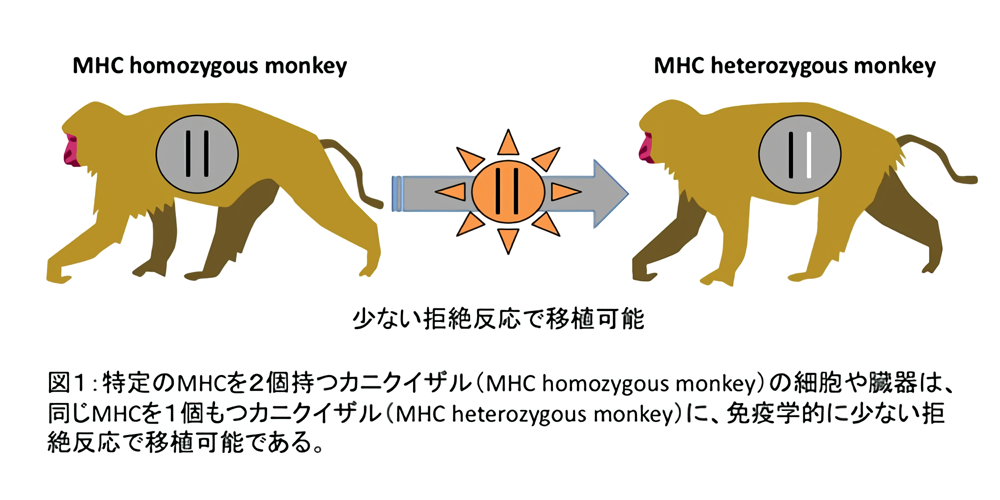
一方、移植の際には主要組織適合抗原複合体(Major histocompatibility antigen complex, MHC)が重要となります。遺伝的に特定のMHCを2個持つ個体の細胞は、同じMHCを1個だけもつ個体に少ない拒絶反応で移植可能です(図1)。将来は、この原理を利用した細胞移植が主流になると考えられますが、MHCの一致する他人のiPS細胞を利用した移植におけるテラトーマの発生についてはこれまで検討されていませんでした。
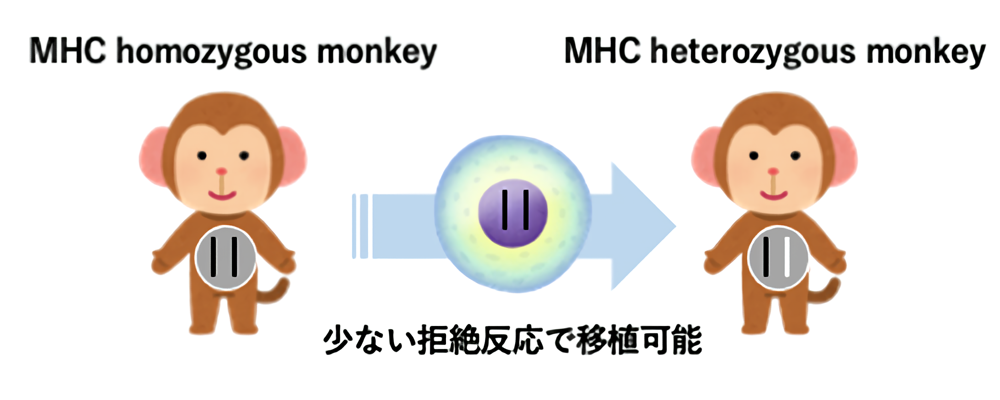
滋賀医科大学動物生命科学研究センターでは、このMHCが同定されているカニクイザルを飼育しています。そこで我々は、線維芽細胞由来のiPS細胞2種類と白血球由来のiPS細胞2種類を、それぞれMHCの適合するカニクイザルに移植し、テラトーマの発生を観察しました。その結果、コントロールとして自己のiPS細胞を移植したカニクイザルにはテラトーマが発生しましたが、MHCの一致した別の個体のiPS細胞を移植したカニクイザルにはテラトーマは発生しませんでした。これらの結果から、将来行われるであろうMHC一致他家iPS細胞移植において、テラトーマの発生の危険性は少ないと考えられました(図2)。
iPS細胞から誘導した癌細胞のMHCの一致したカニクイザルへの移植は、カニクイザル血漿中に抗GRP94抗体の産生を誘導する。
Transplantation of iPS-derived tumor cells with a homozygous MHC haplotype induces GRP94 antibody production in MHC-matched macaques.
Cancer Res 77, 6001-10, 2017. doi: 10.1158/0008-5472.CAN-17-0775.
現在、カニクイザル癌モデルの作成を試みています。ヒトに遺伝的に近い実験動物であるカニクイザルを用いて癌の実験を行い、マウスやラットを用いた実験よりもヒトに応用可能な実験結果を得ることができます。
滋賀医科大学動物生命科学研究センターは、多数のカニクイザルを飼育しています。さらに、移植の際に重要となる主要組織適合抗原複合体(Major histocompatibility complex, MHC)が同定されているカニクイザルも繁殖・維持しています。遺伝的に特定のMHCを2個持つカニクイザルの細胞は、同じMHCを1個だけもつカニクイザルに少ない拒絶反応で移植可能です(図1)。
私達はこれを利用して、カニクイザルの癌モデルを作成することにしました。
つまり、iPS細胞から様々な細胞を分化誘導し癌化させた後、カニクイザルに移植することで、様々なカニクイザル癌モデルが作成できると考えました。
具体的には、私達は特定のMHCを2個もつカニクイザルのiPS細胞を分化させ、ウイルスを用いて癌遺伝子を導入することで、胎児性癌と脳腫瘍(膠芽腫)の癌細胞を作成することに成功しました。しかし、これらの細胞は同じMHCを1個だけもつカニクイザルには生着しませんでした。
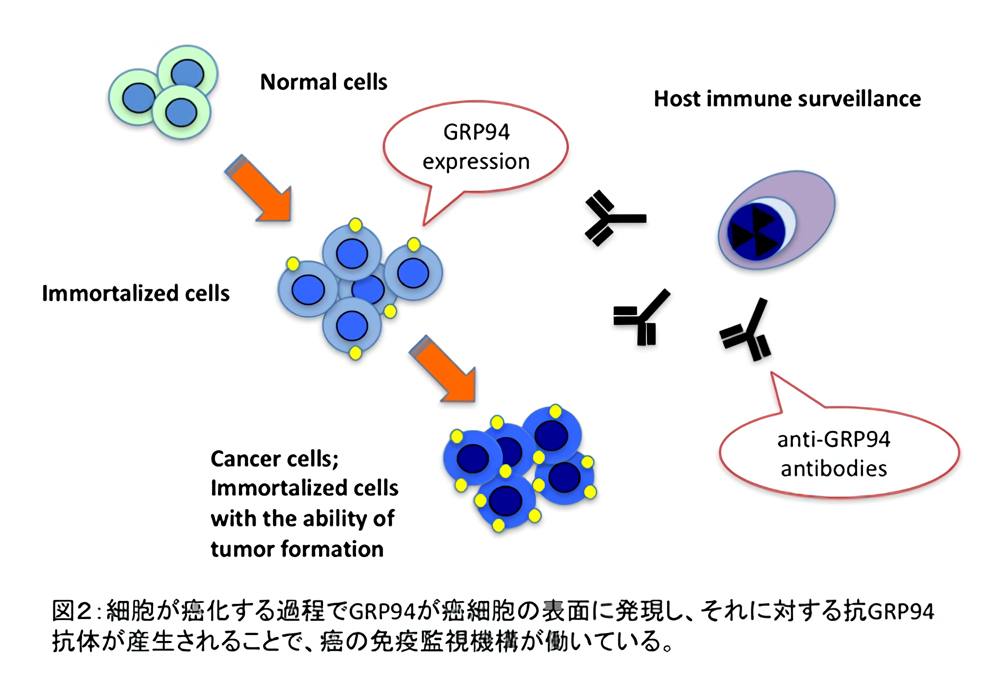
そこで、なぜ生着しなかったかを解析したところ、GRP94というタンパク質が抗原となって免疫反応が起こり拒絶されていることがわかりました。GRP94は熱ショック蛋白と呼ばれるタンパク質の一種で、正常の細胞でも存在するタンパク質です。GRP94はもともと細胞質に存在するタンパク質ですが、私達の解析により、癌遺伝子の導入を重ねることで徐々に細胞表面に発現してくることがわかりました。また癌細胞を拒絶したカニクイザルの血漿から抗GRP94抗体を除くと、試験管内で血漿が癌細胞を殺傷する能力を低下させることも示しました。GRP94が細胞表面に発現するのに伴って、カニクイザルの血液中に抗GRP94抗体が産生され、そのために癌細胞が拒絶されていたのです。
私達の研究により、実際のヒトの体内においても、細胞が癌化する過程でGRP94が癌細胞の表面に発現し、それに対する抗GRP94抗体が産生されることで癌の免疫監視機構が働いている可能性が示唆されました(図2)。
霊長類モデルでのH7N9インフルエンザウイルスに対するワクチンとノイラミニダーゼ阻害薬の効果
Emergence of H7N9 Influenza A Virus Resistant to Neuraminidase Inhibitors in Nonhuman Primates. Antimicrob Agents Chemother 59: 4962-4973, 2015.
doi: 10.1128/AAC.00793-15
2013年に初めてH7N9亜型インフルエンザウイルスの人での感染が確認されました。今のところ、このウイルスには効率よく人から人へ感染する性質はありませんが、今まで流行したことのないウイルスであり、人類はこのウイルスに対する免疫をもっていないので、ワクチンや治療薬の備えが必要となります。そこで我々はH7N9亜型ウイルスに対する現行の抗ウイルス薬、ノイラミニダーゼ阻害剤とワクチンの有効性をサルを用いた実験により明らかにしました。
人から分離されたH7N9亜型インフルエンザウイルス中国株をサルに感染させると、感染から12時間以内に40度を越える熱が見られました。治療しないとウイルスは感染7日後にも検出されるのに対し、発熱したサルに人の治療薬であるオセルタミビルまたはペラミビルを投与すると6頭中2頭ではウイルスは感染から7日後には検出されなくなりました。しかし、他の4頭ではウイルスは感染7日後に検出され、さらにこのうち3頭ではオセルタミビルとペラミビルに対する感受性が低下したウイルス(いわゆる耐性ウイルス)が検出されました。このウイルスには変異があり、タンパク質の構造の変化によりノイラミニダーゼ阻害剤の効果が低下したと考えられました。
次に北海道大学に備蓄されているワクチン候補ライブラリーからA/duck/Mongolia/119/2008 (H7N9)株を選び、ホルマリンで不活化した完全粒子ワクチンを作製しました。このワクチンをサルの皮下に2回接種後、H7N9亜型インフルエンザウイルス中国株を感染させました。ウイルスは感染から2日目までしか検出されず、発熱も軽度で、このワクチンは感染防御に有効であることが明らかになりました。
以上のように、このウイルスに対して有効なワクチンは準備できました。一方、以前の研究から他のインフルエンザウイルスに感染したサルをノイラミニダーゼ阻害剤で治療しても、これほどの頻度で耐性ウイルスは出現しませんので、今後ノイラミニダーゼ阻害剤による治療が行われる患者数が増えると耐性ウイルスがより多く検出される可能性があります。そのため、ノイラミニダーゼ阻害剤による治療を行うときには耐性ウイルスが拡がらないように監視が必要と考えられます。
抗H5ヘマグルチニン抗体(ヒト化キメラ抗体)は高病原性鳥インフルエンザウイルス感染の治療薬として働く
Protective Efficacy of Passive Immunization with Monoclonal Antibodies in Animal Models of H5N1 Highly Pathogenic Avian Influenza Virus Infection.
PLoS Pathogens 10 (6): e1004192, 2014. doi: 10.1371/journal.ppat.1004192
H5N1亜型高病原性鳥インフルエンザウイルス感染では、季節性インフルエンザと同様にノイラミニダーゼ阻害薬が治療薬として投与されてきました。しかし、ノイラミニダーゼ阻害薬による治療を受けた患者から薬剤耐性ウイルスが分離されており、新たな治療薬が必要です。
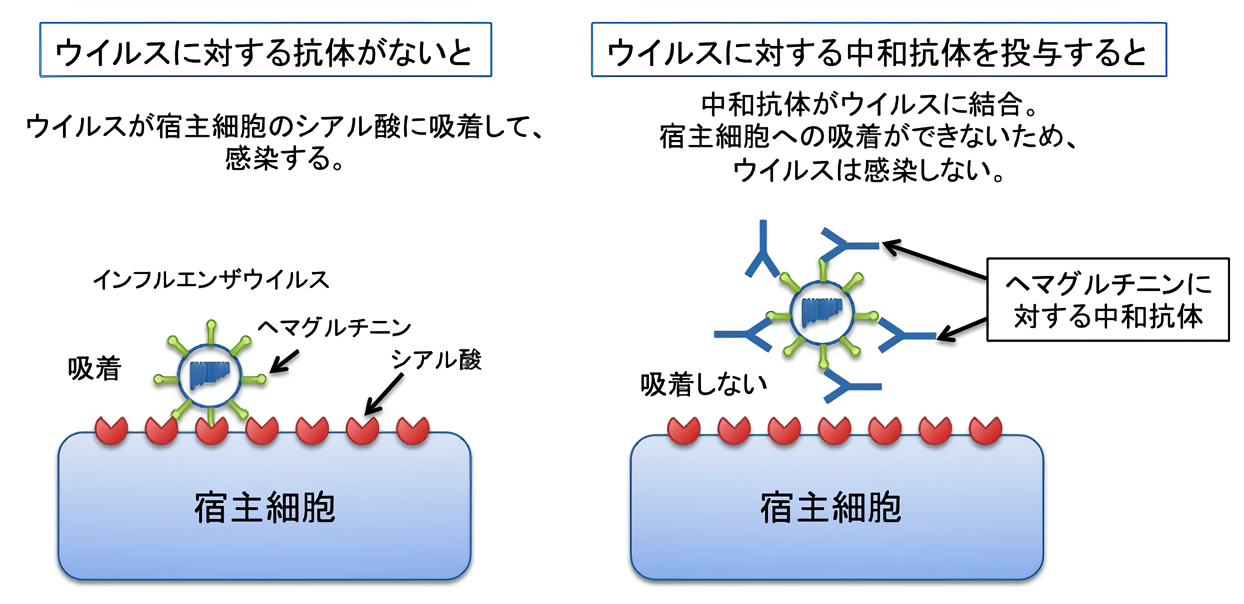
そこで我々はノイラミニダーゼとは別のウイルスタンパク質であるヘマグルチニンに結合する抗体に注目しました。ヘマグルチニンはインフルエンザウイルスが宿主細胞に吸着する際に重要な役割を果たすタンパク質であり、ヘマグルチニンに抗体が結合するとウイルスは宿主細胞に感染することができなくなります。この論文ではカニクイザルを用いて、ヘマグルチニンのサブタイプの1つであるH5ヘマグルチニンに結合する中和抗体(抗H5抗体)による受動免疫療法の有効性を評価しました。
サルにH5N1亜型高病原性鳥インフルエンザウイルスを感染させてから1日後と3日後に抗H5抗体を投与しました。感染から3日後までは呼吸器から検出されるウイルス量は減少し、その結果として生存率が向上しました。しかし、4日目以降はウイルス量が増加する傾向がみられるサルがいて、このサルからは抗体が結合できないような変異を持つウイルス(エスケープミュータント)が検出されました。免疫抑制状態のサルにウイルスを感染させた後、抗H5抗体とノイラミニダーゼ阻害薬を併用したところ、感染後7日までには呼吸器からウイルスは検出されなくなり、エスケープミュータントの出現は見られませんでした。
以上の結果から抗H5抗体はH5N1ウイルス感染に対して有効であり、さらにノイラミニダーゼ阻害薬と併用すればエスケープミュータントの出現を抑えることができ、より高い治療効果が得られることが判明しました。
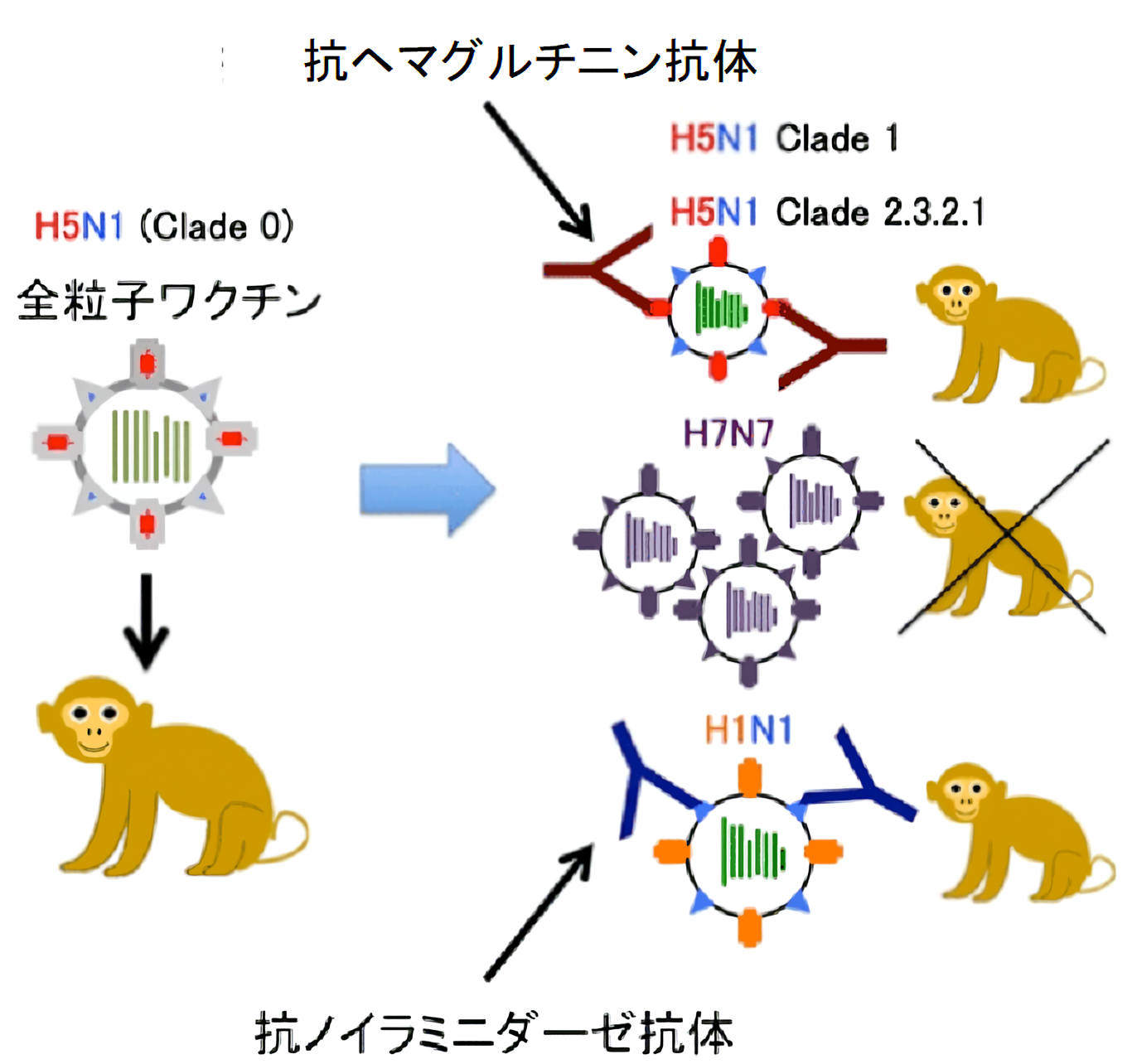
カニクイザルを用いた不活化H5N1全粒子ワクチンのH5N1高病原性鳥インフルエンザおよびパンデミックH1N1インフルエンザウイルスに対する防御効果
Protection against H5N1 highly pathogenic avian and pandemic (H1N1) 2009 influenza virus infection in cynomolgus monkeys by an inactivated H5N1 whole particle vaccine.
PLoS ONE 8: e82740, 2013. doi: 10.1371/journal.pone.0082740
H5N1亜型高病原性鳥インフルエンザウイルスは1997年に人での感染が初めて報告されて以来、計648名に感染し致死率は6割近いことから効果的なワクチンの開発が望まれています。H5N1亜型ウイルスはH5タンパク質とN1タンパク質を表面に発現しており(インフルエンザウイルスの構造、参照)、さらにヘマグルチニンのアミノ酸配列の違いにより、細かく分類(クレード)されています。ウイルスの変異によりクレードが増加し続けていることから、より多くのクレードに対応するワクチンが必要です。そこでカニクイザルを用いて、北海道大学喜田研究室で作製された新しいH5N1亜型の完全粒子ワクチンの有効性を解析しました。
ワクチンを接種しないサルにH5N1ウイルスを感染させると重症ウイルス性肺炎を引き起こしました。しかし、ワクチンを接種しておくと、クレードの異なる2種のH5N1ウイルスをそれぞれ感染させたサルでは症状が改善され、鼻腔や気管支ではウイルス量が減っていました。免疫反応を解析すると、ワクチンを接種したサルでは2株のH5N1ウイルスに対して感染1週間後にヘマグルチニンに対する抗体価が上昇していました。比較のためにノイラミニダーゼのみが一致するパンデミックH1N1亜型ウイルスを感染させたサルでも、ワクチンが感染防御に働きました。免疫反応を解析するとヘマグルチニンに対する抗体価の上昇はみられませんでしたが、ノイラミニダーゼに対する抗体価が上昇していました。一方、ヘマグルチニンもノイラミニダーゼも全く異なるH7N7亜型ウイルスを感染させたサルではワクチンは全く効きませんでした。以上より、今回用いた全粒子ワクチンはクレードの異なるH5N1ウイルスに幅広く効くこと、またヘマグルチニンに対する抗体が産生されなくてもパンデミックH1N1ウイルスではノイラミニダーゼに対する抗体があれば感染防御に働くことが示されました。
免疫低下カニクイザルにおけるパンデミックH1N1亜型インフルエンザウイルスの病原性
Pathogenicity of pandemic H1N1 influenza A virus in immunocompromised cynomolgus macaques.
PLoS ONE 8: e75910, 2013. doi: 10.1371/journal.pone.0075910
2009年に大流行したパンデミックH1N1亜型インフルエンザウイルス(Itoh, Nature参照)は、2013年の時点でパンデミックではなく季節性インフルエンザウイルスの一つになりました。つまり、パンデミックH1N1ウイルスに実際に感染したり、ワクチンを接種することで、多くの人がウイルスに対する免疫を保有している状態になりました。今後問題となるのは、免疫力が低下している人や高齢者が重症化するリスクです。このようなリスクを評価するため、カニクイザルに免疫抑制剤を投与して免疫抑制モデルを作製しました。
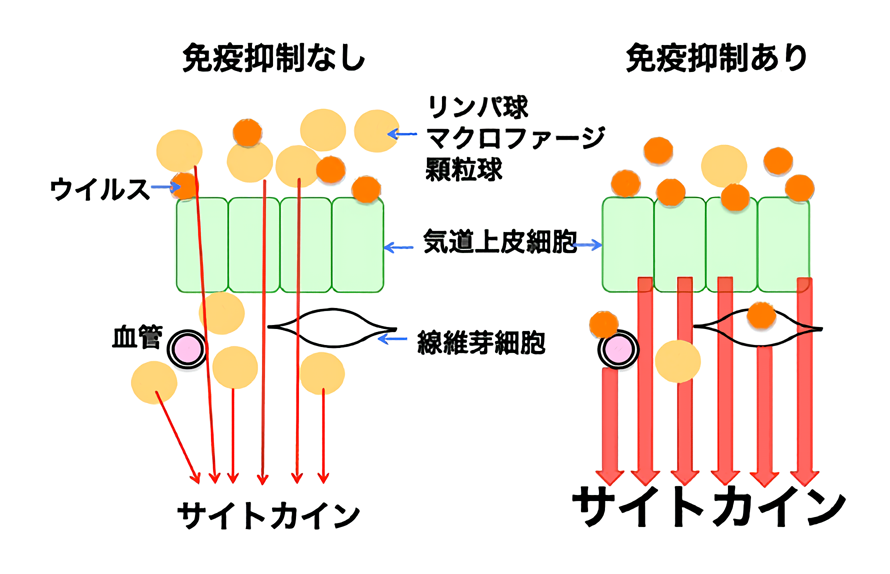
免疫抑制状態のサルにパンデミックH1N1ウイルスを感染させた結果、上気道、下気道でより多くのウイルスが検出されました。免疫抑制状態のサルでは免疫抑制されていないサルと比べて肺炎を起こす白血球の数が減っていましたが、炎症性サイトカインの産生は上昇していました。これまでインフルエンザ感染による重症化には高サイトカイン血症(サイトカインの過剰産生)が関与すると言われており、サイトカインを産生するのは一般的には白血球(リンパ球、マクロファージ、顆粒球など)と考えられていますが、今回の免疫低下サルにおける研究結果からは白血球以外の細胞(気道上皮細胞、線維芽細胞、血管内皮細胞など)がサイトカインを産生している可能性が高いと考えられました。この結果を基に免疫力が低下した人における重症化の予防、治療につなげたいと考えています。
不活化全粒子ワクチンはパンデミックH1N1インフルエンザウイルスに対する免疫記憶を誘導するーMafa-A1*052:02をもつカニクイザルを用いた実験
Memory Immune Responses against Pandemic (H1N1) 2009 Influenza Virus Induced by a Whole Particle Vaccine in Cynomolgus Monkeys Carrying Mafa-A1*052:02
PLoS One 7, e37220, 2012. DOI: 10.1371/journal.pone.0037220
以前より共同研究を行っている北海道大学喜田宏教授の研究室ではインフルエンザウイルスの大流行に備えてワクチンの候補株を備蓄しています。今回は備蓄株からH1N1亜型ウイルスを選び、2009年に登場したパンデミックインフルエンザウイルスに対する有効性をカニクイザルで調べました。
他の実験動物より遺伝学的に人に近いカニクイザルを用いて、人でのワクチン候補の有効性を予測しました。これまでの研究でインフルエンザウイルスに感染したカニクイザルは人とよく似た症状を示すことが判明しています。さらに人では過去のインフルエンザの感染歴やインフルエンザワクチンの接種があるため、純粋にワクチンによる免疫反応を評価することが困難ですが、インフルエンザに感染したことのない(免疫学的にナイーブな状態)カニクイザルを用いるとワクチンによる免疫記憶の誘導効果をより正確に調べることができます。このためインフルエンザウイルス感染の研究において、カニクイザルは有用です。
今回我々はウイルスライブラリーからパンデミックH1N1インフルエンザに対するワクチンとしてA/swine/Hokkaido/2/1981(H1N1)を選び、2種類のワクチンの製法(ホルマリンによる不活化とエーテルによる不活化)を比較しました。完全粒子ワクチンはウイルスをホルマリンで不活化し作製しました。このワクチンはウイルス粒子の形体をそのまま利用します。現在、人で使用されているインフルエンザワクチンは、ウイルスをエーテルで破壊することにより不活化するため、ウイルスは原型をとどめません(スプリットワクチン)。
これらのワクチンをサルの皮下に2回接種したのち、パンデミックインフルエンザを感染させると、完全粒子ワクチンを投与したサルではスプリットワクチンを投与したサルよりもウイルスの複製が抑えられました。血液中の抗体の中和活性を測定したところ、ウイルスに対する中和活性は完全粒子ワクチンを接種されたサルの方が高いことがわかりました。
また今回の実験では主要組織適合抗原複合体(MHC、「簡単免疫学講座」参照)の一部(Mafa-A1*052:02)が一致しているカニクイザルを用いてインフルエンザウイルスの核タンパク質のペプチドに対する記憶CD8陽性細胞(キラーT細胞)の機能を調べました。その結果、完全粒子ワクチンを接種したサルではインフルエンザウイルス核タンパク質ペプチドNP262-270に特異的な記憶CD8陽性細胞がスプリットワクチンを接種したサルより増加していることが判明しました。つまり、完全粒子ワクチンは抗体反応とキラーT細胞の両方においてスプリットワクチンより長期持続するウイルスに対する防御免疫(免疫記憶)を誘導することがカニクイザルで証明されました。
カニクイザルを用いたH7N7亜型高病原性鳥インフルエンザウイルスに対するワクチンの開発
Subcutaneous inoculation of a whole virus particle vaccine prepared from a non-pathogenic virus library induces protective immunity against H7N7 highly pathogenic avian influenza virus in cynomolgus macaques.
Vaccine 28: 780-789, 2010. DOI: 10.1016/j.vaccine.2009.10.067
高病原性鳥インフルエンザウイルスにはH5型とH7型があります。H7N7型高病原性鳥インフルエンザウイルスの人への感染が2003年にオランダで起こり、1名の死亡例が報告されています。H7N7型ウイルスは人で現在流行しているインフルエンザとは抗原性が異なるため、人類は免疫を持っておらず、もし人の体内でよく増えて、伝播するように変異すると大流行になる可能性があります。そこで我々は北海道大学喜田宏先生が先回りして開発したワクチンのH7N7型高病原性鳥インフルエンザウイルスに対する効果をカニクイザルで確認しました。非病原性H7N7型インフルエンザウイルスをホルマリンで不活化した完全粒子ワクチンをサルの皮下に接種すると、抗原特異的抗体反応、ヘルパーT細胞及びキラーT細胞反応が誘導されました。ワクチンを接種したサルにH7N7型高病原性鳥インフルエンザウイルスを感染させると、ウイルス検出期間、発熱持続時間がワクチンを投与されていないサルより短縮し、ワクチンの効果が確認されました。サルで有効性が確認されたので、人でも効果があることが期待されます。
パンデミック(H1N1)2009インフルエンザウイルスの性状
In vitro and in vivo characterization of new swine-origin H1N1 influenza viruses.
Nature 460: 1021-1025, 2009. DOI: 10.1038/nature08260
2009年4月、新型豚由来H1N1インフルエンザウイルス(S-OIV)の人での感染が報告されました。2009年6月11日にはWHOはS-OIVの世界的流行を宣言し、その後も流行が継続しています。大部分の感染者は軽症ですが、特別な基礎疾患のない患者でも入院加療が必要な場合がみられています。これは、S-OIVの潜在的病原性を示しています。そこで、 S-OIVの危険性を知るために、S-OIVの特徴を試験管レベルと生体レベルで解析しました。S-OIVはマウス、フェレット、カニクイザルの肺で増殖し、季節性H1N1インフルエンザウイルスに比べて強い病原性を示しました。また、フェレット間では感染伝播が確認されました。一方、豚ではS-OIVが増殖しましたが、強い病原性は示しませんでした。1918年のスペイン風邪を経験した人の血清のみがS-OIVに対する中和抗体が認められたことから、S-OIVはスペイン風邪ウイルスに抗原性が類似している可能性が示唆されました。種々の抗インフルエンザ薬がS-OIVの増殖を抑えたことから、これらの薬剤は治療に有用であると考えられました。
この研究は東京大学河岡義裕教授、北海道大学喜田宏教授との共同研究です。我々の研究室はカニクイザルでのS-OIVと季節性H1N1インフルエンザウイルスの感染実験を担当しました。

 ホーム
ホーム