4. レビー小体病 (Lewy body disease)
レビー小体型認知症(DLB; dementia with Lewy bodies)の原因は、パーキンソン病と同じα-シヌクレイン(α-synuclein)の異常な神経細胞内凝集が原因と考えられている。パーキンソン病(Parkinsonʼs disease:PD)の患者が認知症になるのは30〜40 %、年率にして10%、一般の高齢者と比較して5〜6倍のリスクがあると言われている。PD、DLB,純粋自律神経不全症(pure autonomic failure: PAF)はいずれもα-シヌクレインの凝集体であるレビー小体が出現するため、レビー小体病(Lewy body disease:LBD)と総称されている。
臨床的には、1年以上前からパーキンソン病の症状(筋固縮、無動・寡動、振戦、姿勢反射障害)が認知症よりも先行している場合には、Parkinson’s disease dementia (PDD)と区別して診断される場合がある。先に認知症が先行する場合には、変動する認知機能障害、具体的な幻視の訴え、レム期睡眠行動異常、便秘や自律神経、MRIで海馬の萎縮が目立たないことなどからDLBを疑う。
Friedrich Heinrich Lewyがパーキンソン病の患者の神経細胞に封入体のあることを最初に報告し、これは後にTrétiakoffによってレビー小体と命名された。レビー小体にはα-シヌクレインが多く含まれており、これが神経細胞の障害に関連していると推測されている。なお、乏突起膠細胞に出現するsynucleinopathyは多系統萎縮症(MSA)に分類されるが、MSAで認知症を伴うことは稀である。LBDは脳幹型(45%)、辺縁型(移行型)(25%)、新皮質型(30%)に分けられ、脳幹型はいわゆるパーキンソン病に相当する。しかしながらこれらのサブタイプは完全に分けられるものではない。DLBの脳にはADの特徴を示す病理所見がしばしば混在しており(したがってアミロイドPETも陽性になることがある)、特に新皮質型ではADのBraak state III-IVが高頻度に認められ、臨床的にもADに似た症状を呈する。現病歴で若いころからの便秘やレム睡眠時行動異常(RBD; REM sleep behavior disorder)を疑わせるような症状、起立性低血圧などの自律神経症状の存在、失神、人や動物などの具体的な幻視の訴え、認知機能障害の程度に動揺性があることなどから本疾患が疑われる。DLBの記憶障害は、大脳辺縁系による記憶入力の障害というよりは記憶を想起する障害と考えられており、ヒントがあると思い出せることも多い。AD患者は笑顔のことが多いが、DLB患者の場合は入室時からやや動作が緩慢で、顔の表情が乏しい。NPI( Neuropsychiatric Inventory)では幻覚、妄想、無欲などの点数が高い。ADほど認知機能の低下は目立たないため、うつ病と間違われることもある。片側性に肘関節の固縮を認めることが多く、この所見はDAT scanの結果(症状と反対側の線状体の取り込み低下)とよく合う。MRIでは海馬の萎縮はADほど強くないことが多い。VBMではADのような特徴的な大脳皮質後半の萎縮パタ-ンは認められない。脳血流SPECTでは後頭葉の血流低下があるとDLBが疑われる。また、ADと比較して後部帯状回の血流低下や代謝が低下しない ”cingulate island sign”が認められる。DAT scan が陰性でもパーキンソン徴候が疑われる際にはMIBG心筋シンチグラフィー(保険適応外)も考慮する。鑑別疾患は他のパーキンソン症候を示す神経変性疾患となる。後述の進行性核上性麻痺(PSP)や大脳基底核変性症(CBD)との鑑別にはMIBG心筋シンチグラフィーや脳血流SPECTが参考になる。脳血流SPECTで後頭葉の血流低下はDLBの60〜70%に認められるとされているが、後頭葉の血流低下を認めてもADのposterior variantの存在を念頭におく必要がある。

Dr. Lewy (1885-1950)、ベルリン生まれ、ユダヤ人。1910年にM.D.
1912年にパーキンソン病の患者からLewy Bodyを初めて報告した。写真は、Members of Alois Alzheimer's research group at the Royal Psychiatric Clinic of the University of Munich, Germany in 1910より。写真の一番右、横向きで立っているのがDr. Lewy 。
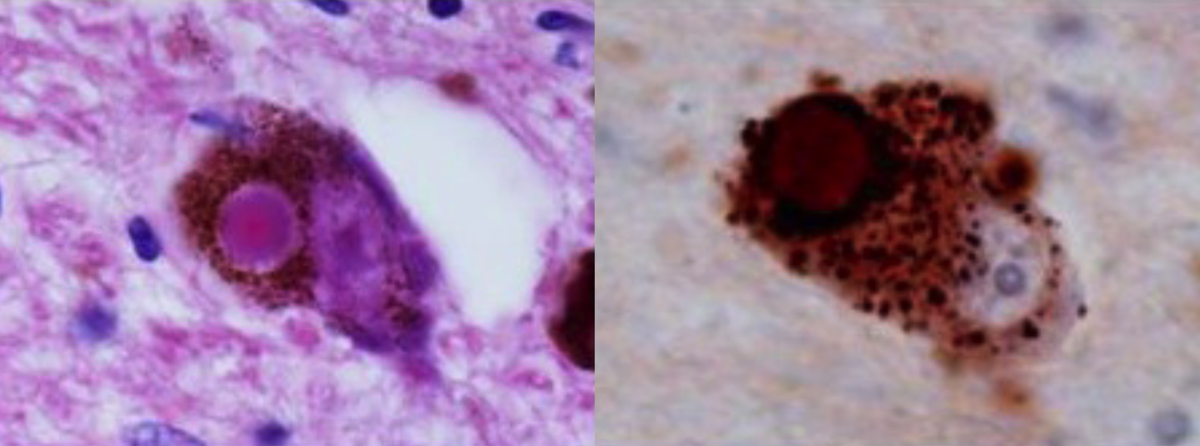
左:黒質のレビー小体(H-E染色)。好酸性のコアと周囲の明瞭なハローが特徴。
右:α-synuclein免疫染色。
疫学
ミネソタ州Olmsted Countyの住民におけるDLBの発生率の報告によると{24042491}、DLBの発症率は、10万人年当たり3.5人で、男性の方が女性よりも多かった(4.8人対2.2人)。一方、パーキンソン病の発症率は、10万人年あたり14.2例と4倍高い。DLBの発症率は、60~69歳で10.3人、70~79歳で44.5人、80~99歳で30.1人と、年齢とともに増加していた。60歳以降の発症率は、男性の方が女性よりも明らかに多かった。PDDの発症率は全体で10万人年あたり2.5人で、男女ともに同程度(2.3人対2.7人)。PDDの全体的な発症率は、50~59歳の0.6人から80~99歳の47.0人まで、一貫して年齢とともに増加していた。全体の発症率は男女ともに同程度であったが、最高齢層では男性の方が女性よりも明らかに多かった(80~99歳の男性68.1人、女性37.9人)。
DLB患者はPDD患者に比べて発症時の年齢が若く(中央値;76.3歳対81.4歳)、幻覚(62.5%対20.0%)や認知機能の変動(25.0%対8.9%)の頻度が高かった。統計的な有意性は認められなかったが、DLB患者はPDD患者に比べてミオクローヌスの頻度が高かった(12.5%対4.4%)。PDDの発症率は、DLBよりも大幅に少なかった(10万人年あたりの発症率は2.5対3.5)。しかし、PDDの発症率は、この疾患の実際の発生を過小評価している可能性がある。PDDの特徴は、過去にパーキンソン病と診断された患者に認知症が発症することで、臨床現場では、軽度の認知症は、変動する運動症状、ジスキネジア、睡眠障害、自律神経失調症など、薬の調整が必要なパーキンソン病の問題に隠れてしまう可能性がある。そのため、中等度または重度の認知症患者のみがPDDとして特定されている可能性がある。
臨床診断と病理診断の一致率は、DLBでは94.1%(17例中16例)であり、不一致の1例は、レビー小体やタウの封入体を認めないアルツハイマー病の病理診断であった。一方、PDDでは57.1%にとどまった(14例中8例)。レビー小体を認めなかった症例はいずれも軽度から中等度の脳の萎縮があり、4例は黒質の軽度の色素脱失、3例はアルツハイマー病、1例はタウ封入体を認めた。DLBにはアルツハイマー病の病理学的特徴が頻繁に共存しており、典型的なPDDではその特徴が控えめになる傾向がある{24042491}。
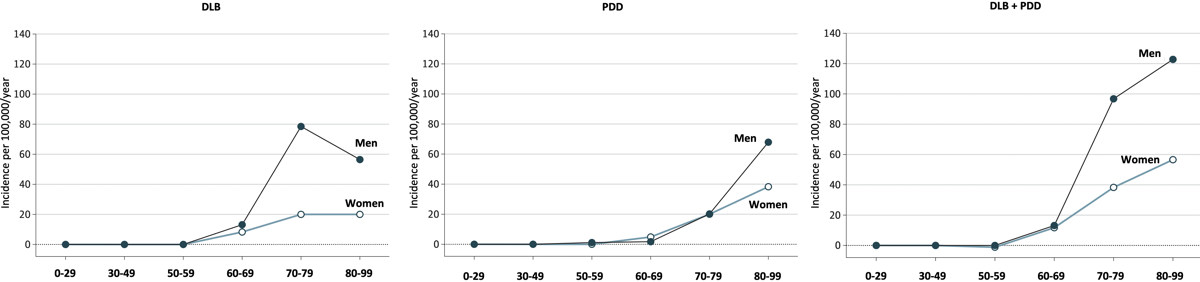
(Savica R., et al., JAMA Neurol, 2013)
症状
AD患者は笑顔のことが多いが、DLB患者の場合は入室時からやや動作が緩慢で、顔の表情が乏しい。NPI (Neuropsychiatric Inventory)では幻覚、妄想、無欲などの点数が高い。
認知機能障害:通常、アルツハイマー病と比較して記憶障害の程度は軽く、注意・集中障害による前頭葉性の記憶障害が主体となる。このため、MMSEの際には注意が向くので比較的良い成績を示す。また、認知機能のレベルも変動しやすい。日内変動から数週-数ヶ月の変動があり、前頭葉だけでなく脳幹の覚醒系の影響も考えられている。幻覚:幻視は,単純幻視(点,星,稲妻などの光視)と複雑幻視(人や動物など具体的なもの)に分けられるが、レビー小体型認知症では、人物、動物、虫などの現実に近い生き生きとした幻視を訴える複雑幻視が特徴的で、最初の症状の一つであり、しばしば繰り返して出現する。夕方など薄暗い時に起きる傾向がある。幻視から妄想になることは少なく、患者はある程度幻視であることを自覚していることが多い。
DLB の患者では錯視の傾向が強いことも知られている。例えば、ハンガーにかかっている服を「人」と誤って認識したり、壁のシミを人の顔と誤ったりするが、これは幻視ではなく錯視になる。視覚、聴覚の情報を類似する既知のものと誤認してしまうことをパレイドリア(pareidolia)と呼武。これは正常な人でも時に経験するが、通常は軽度の意識障害に伴って認められる。興味深いことにDLBの患者ではパレイドリアが頻回に認められ、コリンエステラーゼ阻害薬の投与により改善する。脳幹のアセチルコリン低下に伴う注意障害が、幻視やパレイドリアに関与していると考えられている。Noise Pareidolia Testは図のような40枚のパネルを被検者に見せて、人の顔の存在の有無を問う検査(実際に顔があるのは8枚)で、DLBの患者は顔でない部位を顔と認識することが多いと言われている。本来、ヒトの脳は3つの点があるとヒトの顔と認識する傾向(シミュラクラ現象)があルが、Noise Pareidolia Test はこれを利用したものになる。この検査を実施したい場合は、筆者が用意したページ(http://mr-igaku.jp/ninti/)を参照してください。

Noise Pareidolia test。
試験用パネルと26番パネルを提示。26番パネルには人の顔は存在しないが、DLBの患者では、しばしば丸で示した領域を人の顔と誤認する。
DLBの幻視と似た現象にシャルル・ボネ(Charles Bonnet)症候群がある。白内障や半盲など視覚系の障害のある高齢者にしばしば認められ、DLBのように具体的な幻視が多い。視覚刺激の遮断に伴う大脳皮質の過剰な活動が原因と考えられており、幻視の内容は自由連想や空想的なものが多く、患者本人は幻覚であることを冷静に受け止めていることがほとんど。白内障や半盲などの視覚障害がない場合でも認められることがあり、後にDLB か原因であったことが判明する症例もある。
運動障害:パーキンソン病の徴候として、動きが鈍くなったり、筋肉が硬直したり、震えたり、歩き方がぎこちなくなる。姿勢反射も悪く、転倒しやすくなる。
自律神経系障害:血圧、脈拍、発汗、消化などの機能は、レビー小体型認知症で影響を受けることが多い自律神経で調節されている。そのため、起立時の急激な血圧低下(起立性低血圧)、めまい、転倒、膀胱のコントロールができなくなる(尿失禁)、便秘などが起こる。
嗅覚障害:嗅覚障害は病早期から見られ、パーキンソン病の70%異常に出現する。MSA、PSP、CBD、本態性振戦、血管性パーキンソニズムとの鑑別の参考になる。
画像検査
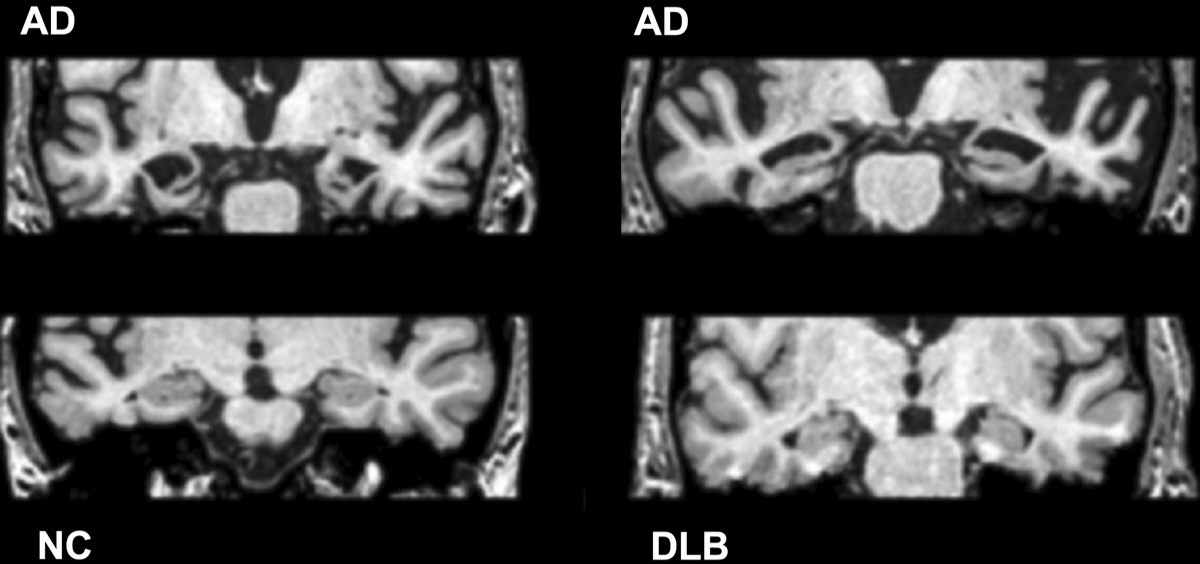
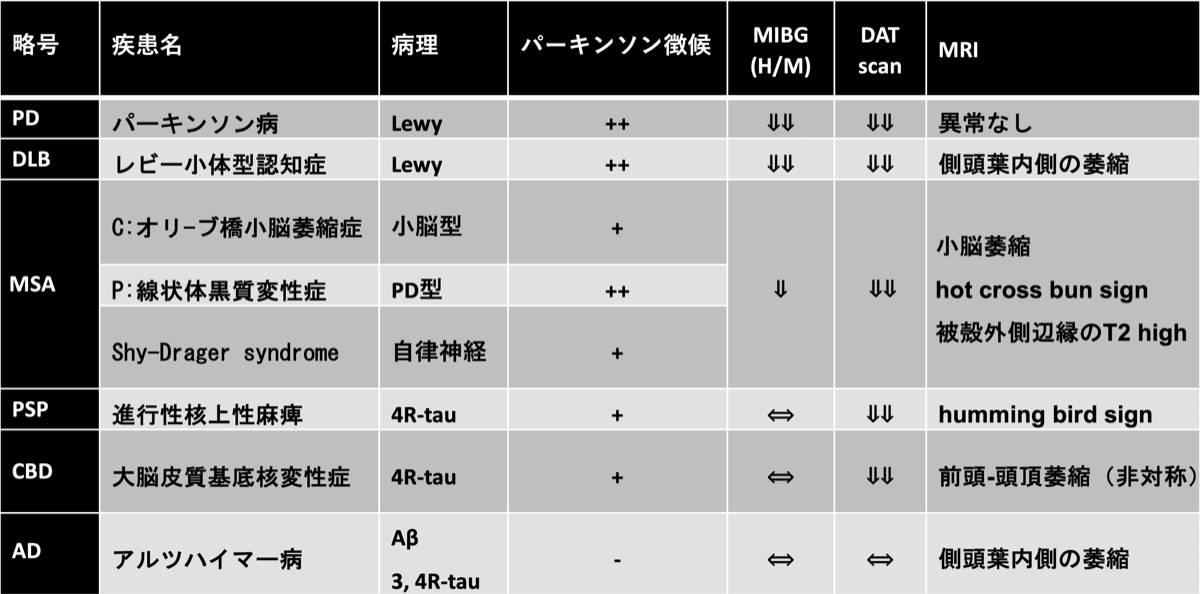
レビー小体型認知症では海馬の萎縮はADと比べると軽微(下図)。レビー小体型認知症の記憶低下は、注意・集中低下に伴うもので、常に出現せずにまばらに見られたり、ヒントがあれば思い出させたりする。一方、経験記憶のハブである海馬に病変のあるアルツハイマー病では、このようなまだらな経験記憶の低下は目立たない。
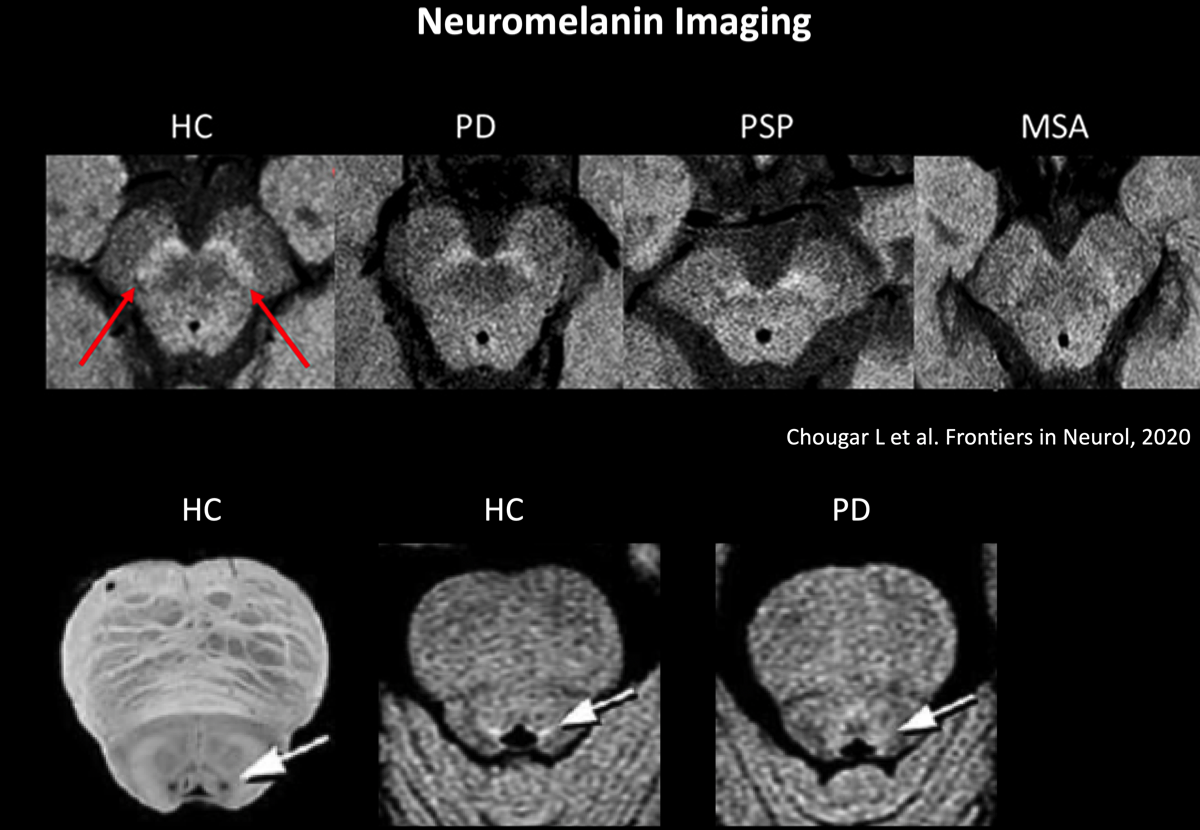
3TのMR装置でT1強調fast spin-echo 法で撮像すると、神経メラニンが高信号として観られる(右図)。
パーキンソン病(PD)の病変の首座は中脳の黒質緻密部(substantia nigra pars compacta:SNc)のドパミン(DA)作動性ニューロンで、スライドの赤矢印の部位として認めらるが、パーキンソン症候群では、同部位の信号が減少している。青斑核も同様にパーキンソン病では信号の低下が認められる。
ただし、これらの初見は診断する上で、やや確実性にかけるとの指摘もある。
Dopamine Transporter (DaT) SPECT
DAT(dopamine transporter)のSPECT画像は、線条体におけるドパミントランスポーターの分布を可視化することで、ドパミン神経の変性・脱落を伴うパーキンソン病(PD)を含むパーキンソン症候群や、レビー小体型認知症(DLB)の診断に用いられる。静注から3時間後に撮像するが、待っている間は飲食自由。薬剤に5%エタノールが含有されているため、アルコール過敏症の患者には注意を要する。SSRIは集積を上昇、中枢神経刺激剤(メチルフェニデート塩酸塩、アモキサピン、マジンドール、コカイン塩酸 塩、メタンフェタミン塩酸塩 など)は集積を低下させる可能性があるので、5半減期以上の休薬が必要。
パーキンソン病(PD)では線状体DATへの結合(取り込み)低下が認められる。初期の片側性のPDの場合でも両側の線条体の取り込み低下が見られ、症状とは反対側の被殻後部の取り込み低下が強く認められる。取り込みの低下は、患者の固縮(rigidity)と動作緩徐(bradykinesia)の程度を反映するが、振戦の程度とは関係しない。PDの場合、被殻にけるドパミン代謝の異常は症状が出る前から認められる。18F-dopa PET(ドパミンの合成と貯蔵を反映)で家族性PDの家系で無症状の段階で調べたところ、25%に取り込みの低下が認められ、少なくともその1/3は追跡調査でPDを発症したことが確認されている{9029071}。さらに、PETの研究ではDATの取り込み低下は18F-dopa の低下よりも早期に出現する可能性が指摘されている{10762161}。DaT SPECTにおいて、取り込みの低下はPSPやCBDでも認められるので、後述のMIBGなどの検査で鑑別する必要がある。PSPの場合、DATの取り込み低下は左右対称的に認められることが多い。
臨床的にパーキンソン病の診断基準を満たすが、DAT検査で異常が認められない症例をSWEDDs(scan without evidence of dopaminergic deficits)の症例が10-20%存在する。これらの症例は数年後に再検査しても異常を示さないことから、パーキンソン病の初期ではないと考えられている。嗅覚障害がない、L-dopaが効かないなどの特徴がある。
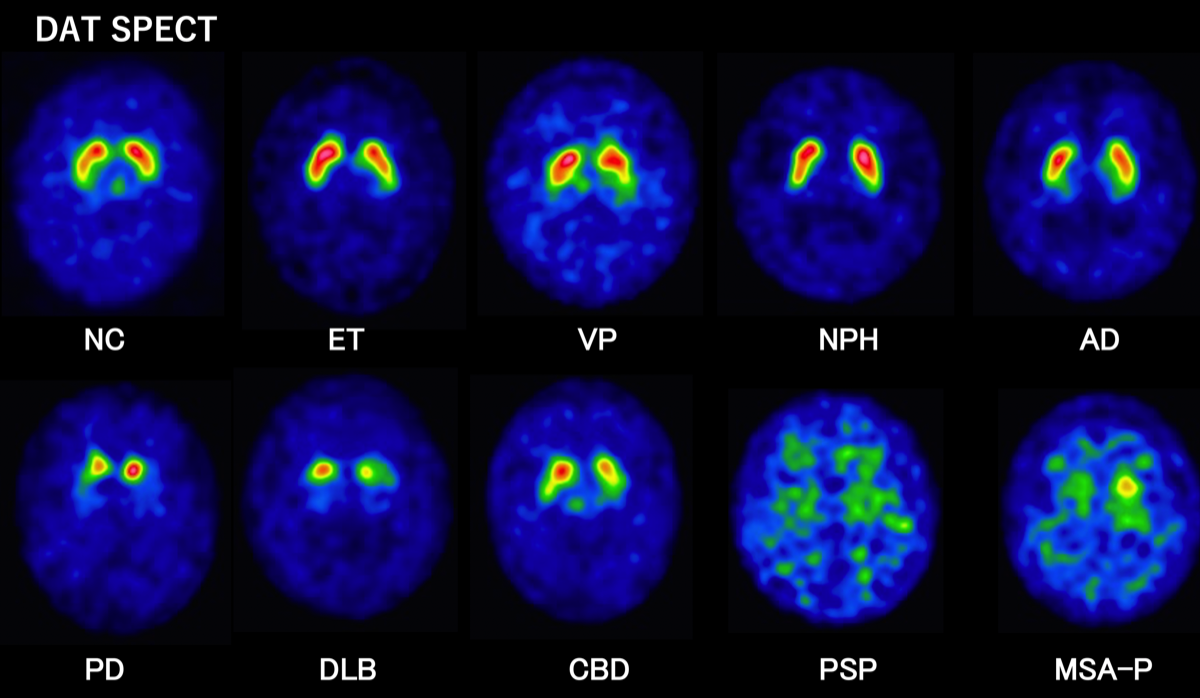
NC; normal control (NC), ET; essential tremor, DiP; drug-induced parkinsonism, VP; vascular parkinsonism, NPH; normal pressure hydrocephalus, PD; Parkinson’s disease, PSP; progressive supranuclear palsy, CBD; corticobasal degeneration.
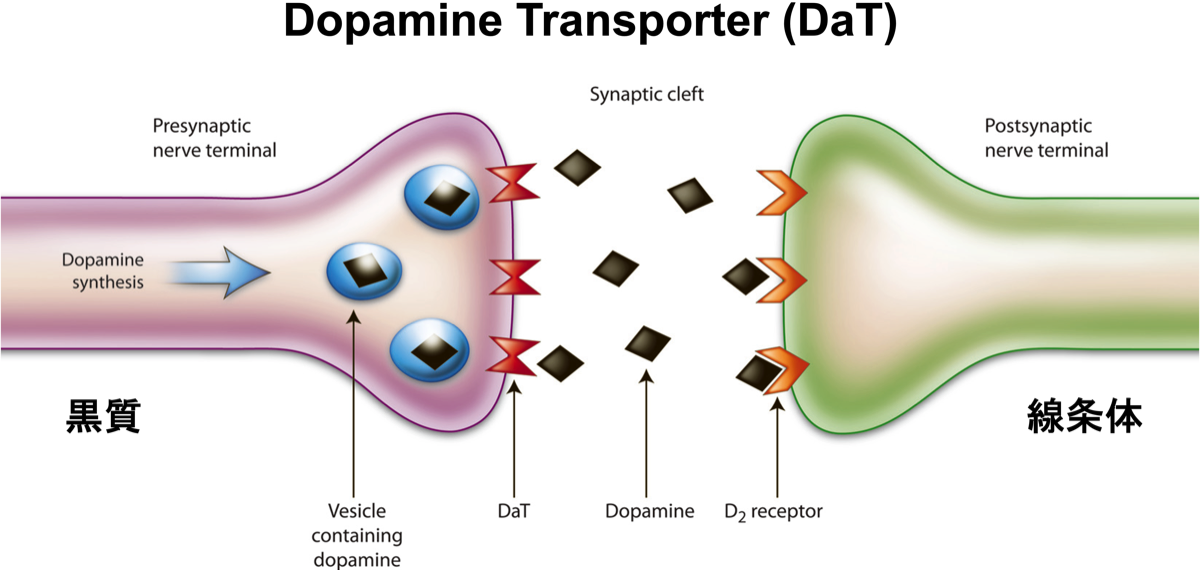
黒質のドーパミンニューロンの終末は、線条体でドーパミンを放出する。放出されたドーパミンの一部は、黒質のドーパミンニューロンの終末のドパミントランスポーターで吸収され、シナプス小胞に蓄積される。黒質のドーパミンニューロンの減少は、ドパミントランスポーターの減少として捉えることができる。したがって、レビー小体病以外にも、PSPやCBD、MSAでも取り込みの減少が認められる。一方、アルツハイマー病や特発性正常圧水頭症では、取り込みの減少は認められない。
MIBG 検査
123I-MIBG(metaiodobenzylguanidine)は、分子構造がノルエピネフリンと類似したアナログで、交感神経末端においても同様に取り込まれ貯蔵顆粒に貯蔵される。心筋への集積は主に能動輸送であるuptake-1による。褐色細胞腫、傍神経節腫瘍、小児の神経芽腫などの副腎髄質や交感神経から発生した腫瘍に集まることから、これらの腫瘍診断に使われる。
静注15分後に初期像、3〜4時間後に後期像を撮像する。心臓/縦隔比(H/M比)を求めて判定する。縦隔の関心領域は、心臓からの散乱の影響の少ない、縦隔上部に設定する。ROIの設定方法、装置やコリメーターにより測定値は変化するため、H/M比の閾値は施設ごとに異なるが、初期、後期画像とも2.1~2.2以上を正常とすることが多い。Washout rateとして、{(初期H-初期M)-(後期H-後期M)}/(初期H-初期M)を算出することがある。H/M 比は年齢、性別、人種など、患者に関連するさまざまな生理的要因に関係する。実際、H/M比は加齢とともに減少し、女性は通常、同年齢の男性よりも有意に高いH/M比を示すことが実証されている{19057084}。さらに、白人集団のH/M閾値は日本人のそれとは異なる可能性がある。
三環系・四環系抗うつ剤、交感神経刺激剤・緩和剤は結果に影響する可能性があるので1~2日間内服を控えてもらう。三環系および四環系抗うつ薬やレセルピンは心筋のMIBG取り込みを阻害するが、カルシウム拮抗薬はMIBGの心筋取り込みを増加または延長させる。
正常心筋では多くの交感神経終末が存在するためMIBGの高い集積がみられるが、交感神経機能の脱落した除神経領域ではMIBGは集積しない。また、その洗い出し率は交感神経の活動性を反映するとされている。最近では後期像のH/M比が、心不全症例の予後に密接な関係があるとの報告されている。このため、冠動脈疾患(心筋虚血)の存在はパーキンソニズムを目的とした場合には注意が必要である。
123I-MIBG シンチグラフィーは、早期のPDに対する感度は低いとする報告{20351351}があるが、初期のPDであっても検出感度は変わらないとする報告もある{20975774}。大脳黒質ドパミン神経変性症と頭蓋外交感神経レビー小体変性症がそれぞれ独立して起こるかどうかは不明である。大脳黒質のみ変性し、頭蓋外の交感神経系は変性しない、あるいはその逆の "極端な "症例もあり得るかもしれない。Spiegelらは、各Hoehn and Yahrステージにおいて、大脳黒質ドパミン作動性変性と頭蓋外の心筋交感神経変性の間に有意な相関があると報告している{19018276}。罹患期間が1年未満、振戦が優位の表現型、いくつかの遺伝的なPDでは偽陰性が出る可能性が指摘されている{21792729}。
日本で実施されたADとDLBの鑑別のための多施設研究では、心臓/縦隔(H/M)比に換算して、H/M比=2.1が、最適境界値であり{25793585}、ミニメンタルステート検査(MMSE)≥22の軽症症例では感度77%、特異度94%であった。
他の報告では、パーキンソン病とPSP、CBD、MSAを鑑別する際の早期像の感度/特異度は 82.6%/89.2%、後期像の感度/特異度は 89.7%/ 82.6%であった。{22321865}
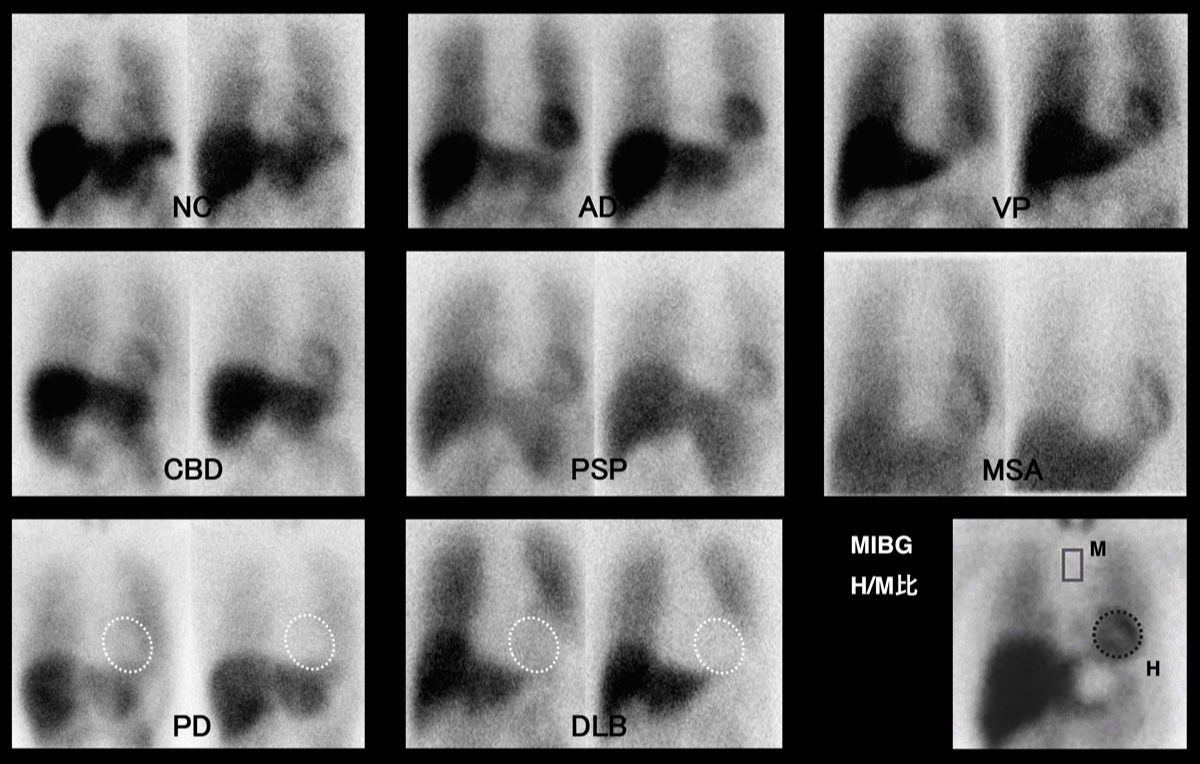
MSAでMIBGの集積低下がほとんど認められないのは、自律神経障害の責任病巣が脳脊髄の節前線維の障害のためと考えられている。
PDとMSAの鑑別診断におけるプールされた感度と特異度はそれぞれ89%(95%CI 86-91%)と77%(95%CI 68-84%)、PDとPSPの鑑別診断における感度と特異度はそれぞれ87%(95%CI 84-90%)と77%(95%CI 64-86%)、PDとETの鑑別診断ではそれぞれ92%(95% CI 86-96%)と100%(95% CI 90-100%)であった{21792729}。
FDG PET, 脳血流SPECT
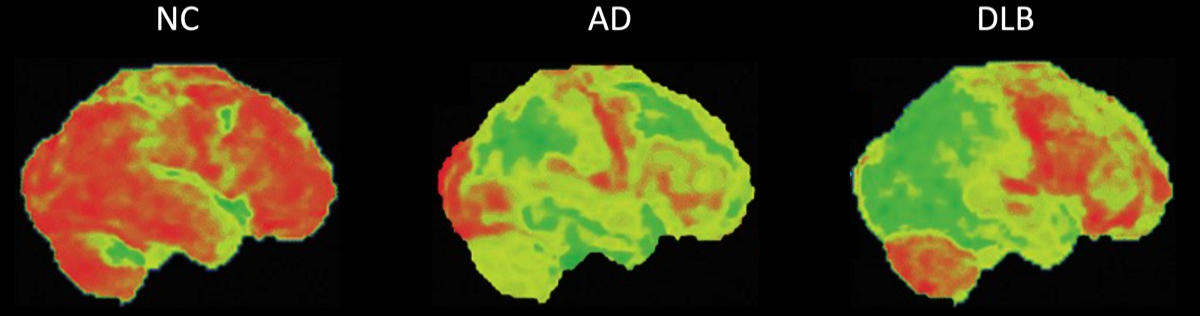
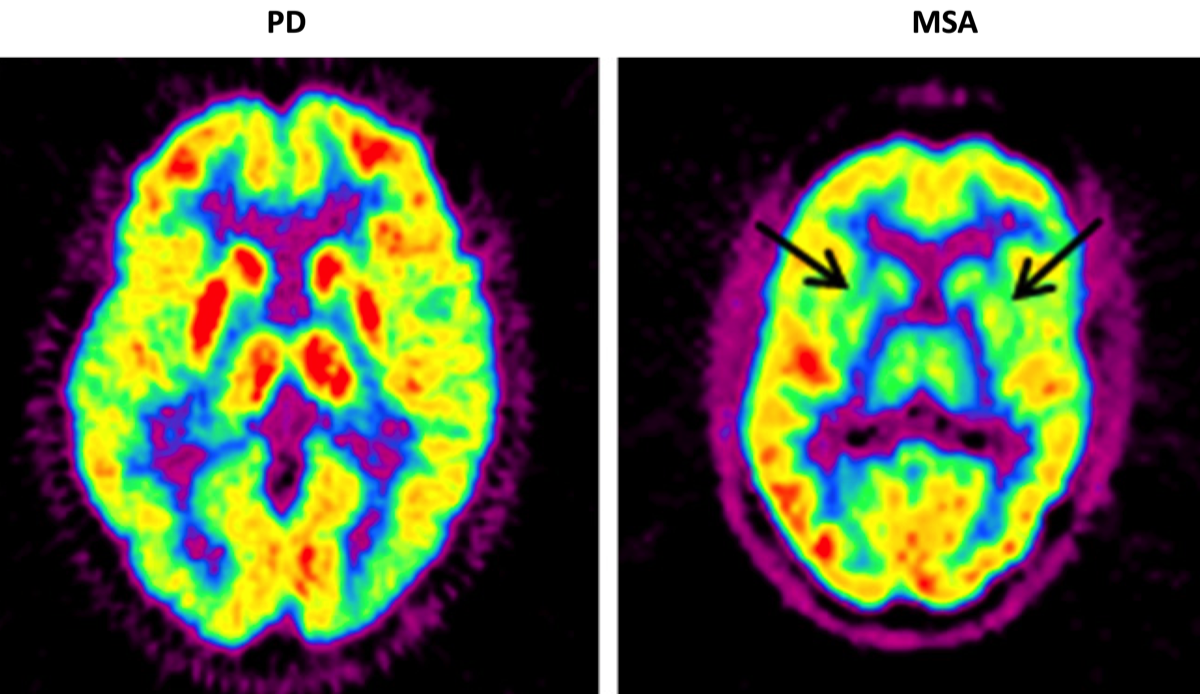
後頭葉のグルコース代謝や脳血流の低下が支持的バイオマーカーとされているが、はっきりしない症例も多い。FDG PETでのDLB/ADの鑑別は、感度/特異度が70%/74%、HMPAO脳血流で65%/64%であった{28592453}。DLBの特徴として、ADと比較して後部帯状回の代謝・血流が保たれていることがあり、cingulate island sign (CIS)と呼ばれる。
右図でDLBの症例はグルコース代謝の低下が後頭葉にまで及んでいる。白色の矢印はADと比較して後部帯状回の代謝が保たれている(CIS)を示す。
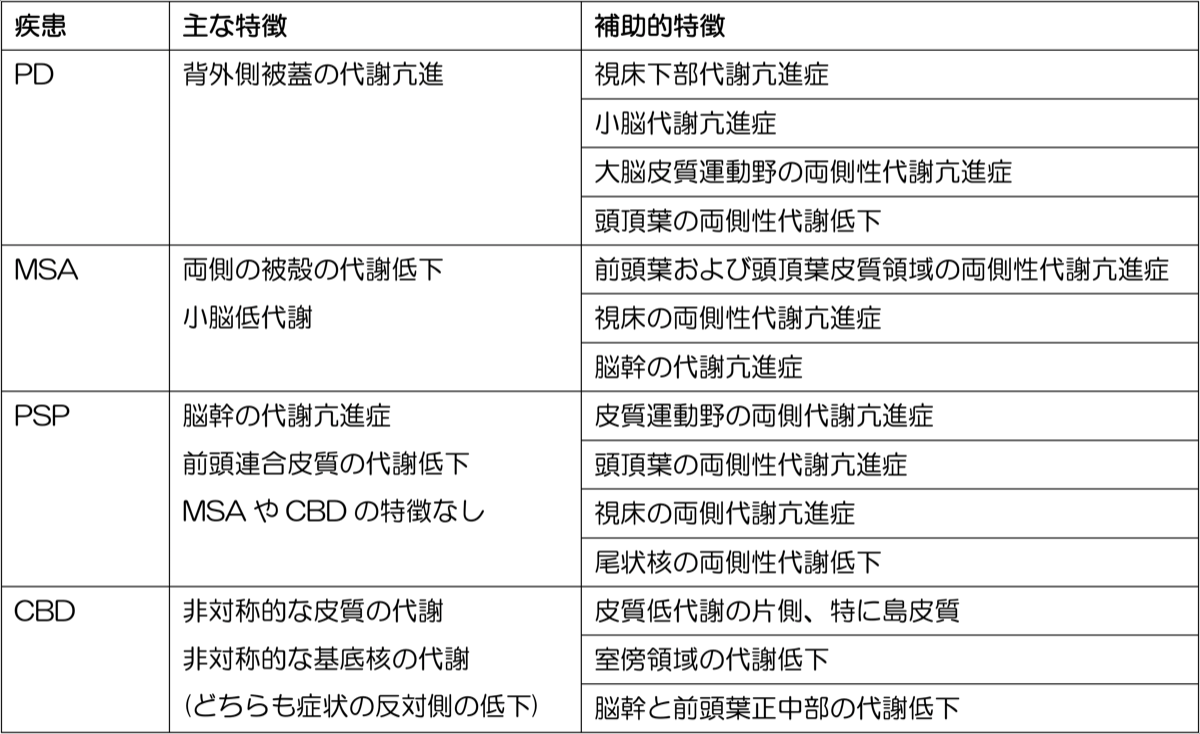
フルオロデオキシグルコース(FDG)PETの多くの研究で、PD患者における糖代謝の特徴的なパターンが報告されている。Eckertらは135名のパーキンソニズム患者をFDG PETに紹介し、そのスキャンに基づいて正確に診断ができるかどうかを検討した{15955501}。その結果、盲検化されたコンピューター診断は、全対象者の92.4%において臨床診断と一致した(早期PD 97.7%、後期PD 91.6%、MSA 96%、PSP 85%、CBD 90.1%、健常者 86.5%)。彼らがまとめたそれぞれの疾患の特徴を表に示す。
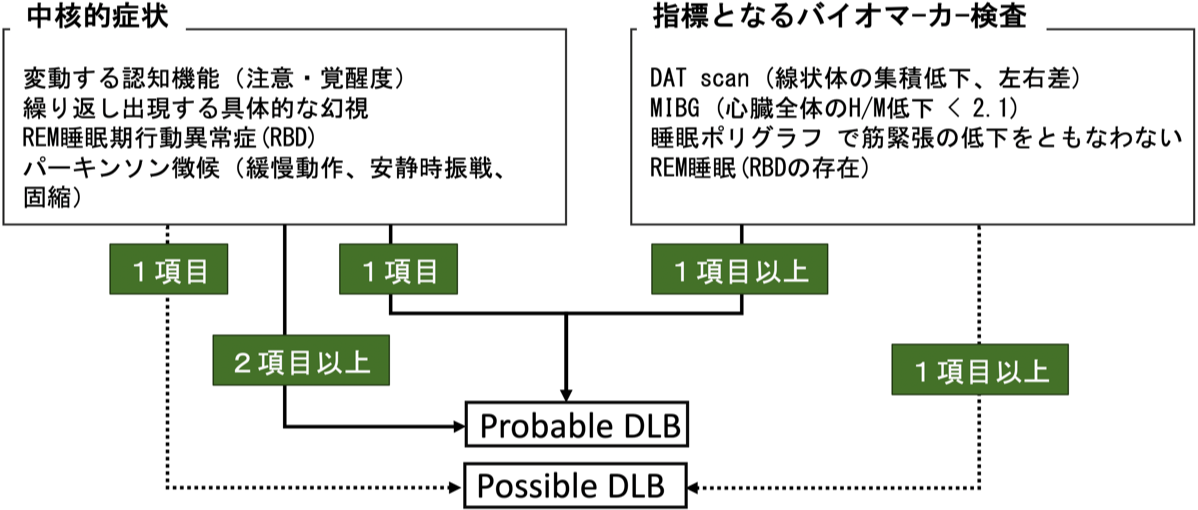
レビー小体型認知症の診断基準(McKeith IG et al., Neurology, 2017) { 28592453}
中核的症状(初期からおそらく進行期まで認められる)
変動する認知機能(注意・覚醒度)
繰り返し出現する具体的な幻視
REM睡眠期行動異常症(RBD)
1つ以上の主要なパーキンソン徴候(緩慢動作、安静時振戦、固縮)
支持する症状
向精神病薬への感受性亢進
姿勢反射障害
繰り返す転倒
失神、一過性の意識消失
顕著な自律神経障害 (便秘、起立性低血圧、尿失禁)
睡眠過剰
嗅覚低下
幻視以外の幻覚
妄想
アパシ-
不安
抑欝症状
指標となるバイオマ-カ-検査注1
DAT scan (線状体の集積低下、左右差)
MIBG (心臓全体のH/M低下)
睡眠ポリグラフ で筋緊張の低下をともなわないREM睡眠(RBDの存在)
支持的バイオマ-カ-検査
側頭葉内側の萎縮は目立たない
SPECT/PETで後頭葉の血流(代謝)低下、Cingulate island sign (FDG PET)
脳波で顕著な後頭部の周期的な変動(pre-α〜θ)を伴った徐波化
Probable DLB
少なくとも2つ以上の中核的症状がある
or
中核的症状は1つだが、1つ以上の指標となるバイオマ-カ-検査が陽性
Possible DLB
1つの中核的症状のみ
or
中核的症状はないが指標となるバイオマ-カ-検査が1つ以上陽性
注1:括弧内は原著にはなく、参考のため追記。H/M(心臓/縦隔)比の値はearly, delayなどの条件、施設によって基準値は異なる。
☞ RBD (REM sleep Behavior Disorder)
レム睡眠期には骨格筋が弛緩しているため夢を見ても眼球以外の動きは目立たないが、RBDでは骨格筋の弛緩がないため、夢に反応した手足の行動が表れる。結果、就寝中に大きな声で寝言を言う、笑う、突然座る、暴れる、モノを投げつけるなどの動作が出現する。パーキンソン病、レビー小体型認知症、多系統萎縮症などシヌクレイノパチ-などで認められるが、RBDの6割は原因不明で脳血管障害やミトコンドリア脳筋症などでも認められる。50歳以降の男性に多い。発症時に覚醒させると夢の内容が想起できること、見当識障害がないことなどから、夜間せん妄やてんかんなどと区別する。
REM 睡眠期には橋の下背外側核(SLD),外背側被蓋核 (LDTN)と前青斑核群(PC)が骨格筋の動きを抑制するが,DLB ではこれらの核群の障害によ り骨格筋が弛緩しないため、RBDが出現すると考えられている。クロナゼパム0.5-2.0mgの就寝時投与が有効。
カプグラ症候群とは、自分の友人や配偶者、両親その他近親者などが、瓜二つの外見の別人に入れ替わってしまったと確信する妄想で、Capgrasによって「ソジーの錯覚」として報告された。
フレゴリ症候群は、ある人物が色々な人に変装し迫害してくると確信する妄想で、舞台で素早い変装で有名な役者の名前にちなんだもの。
カプグラ症候群,フレゴリ症候群,相互変身症候群,自己分身症候群をまとめて,妄想性誤認症候群として考え、脳血管障害,頭部外傷,レビー小体型認知症,アルツハイマー病などの脳器質疾患や統合失調症での報告がされている。
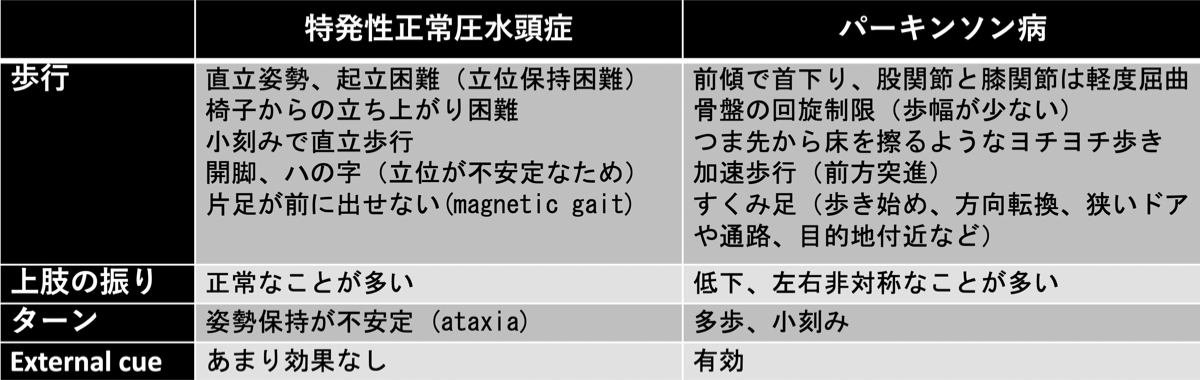
☞ Parkinsonian gait (Shuffling, short-stepped gait)
筋肉の固縮が原因。前傾姿勢で小刻(短い歩長)みで引きずるように歩く。歩行中、股関節と膝関節は完全に進展しない。歩長は変動しやすい。上肢はほとんど振らない。歩き出しの1歩が出にくい。正常圧水頭症と異なり、足はあまり開脚して外旋しない。また、歩幅程度に等間隔に引いた線があると歩幅は改善し、リズム音があると歩調が改善する(visual or auditory cueing)。
☞ 正常圧水頭症では膝関節と足関節の可動が小さい。姿勢は直立しており、起立が不安定なため、歩幅が広く足は外旋位で歩行時にすり足で両足で接地している時間が長い。Freezing現象はPDでもiNPHでも認められる。
パーキンソン病では、転倒の約40%がつまずきによるものと報告されている{19854057}。転倒はQOLの低下に直結し、転倒の恐怖、骨折、自立度の低下、さらには死亡といったいくつかの合併症を引き起こす可能性がある。
パーキンソン病におけるつまずきの原因の一因として、段差の認知誤認の可能性が指摘されている。パーキンソン病群では実際の段差の高さが過小評価し、対照群であるOA群では段差の高さが過大評価していたとする報告がある{30501375}。
(メモ)パーキンソン病の歩行障害に対するハビリテーションとして、Automated Mechanical Peripheral Stimulation:AMPS治療がある。 AMPSはGondola(Gondola Medical Technologies SA, Switzerland)と呼ばれる装置を用いて、母趾頭部とそのMPT関節 (first metatarsal joint) に丸い刺激チップで機会的圧力を加える。AMPSによる治療は徐脈に効果があり、歩行速度や歩行安定性の改善が期待できる{26798550}。
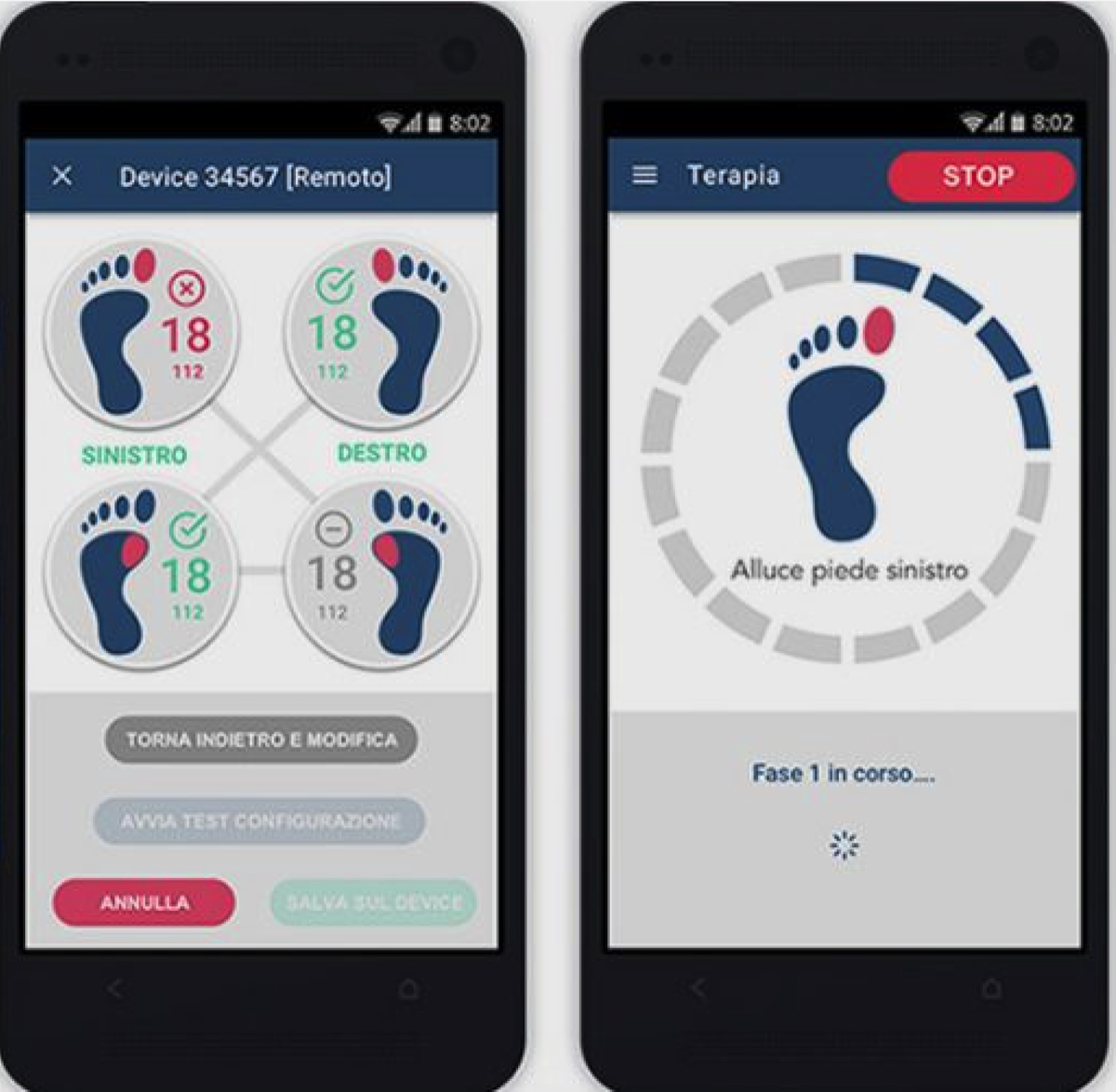
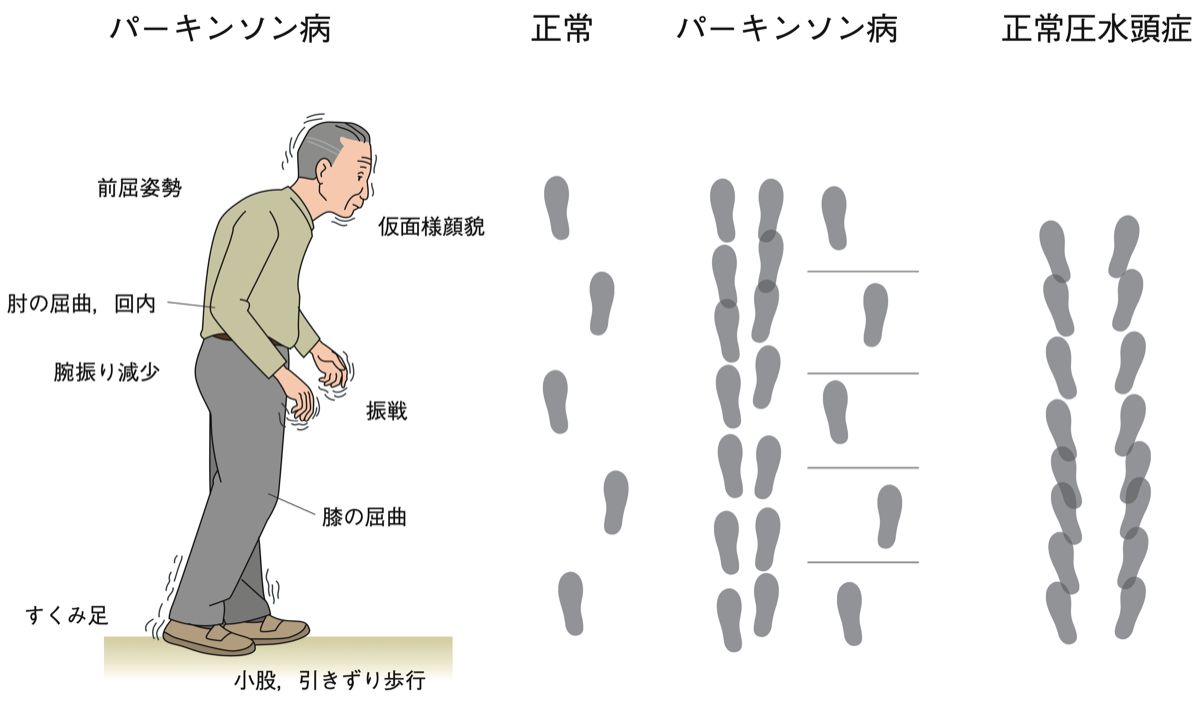
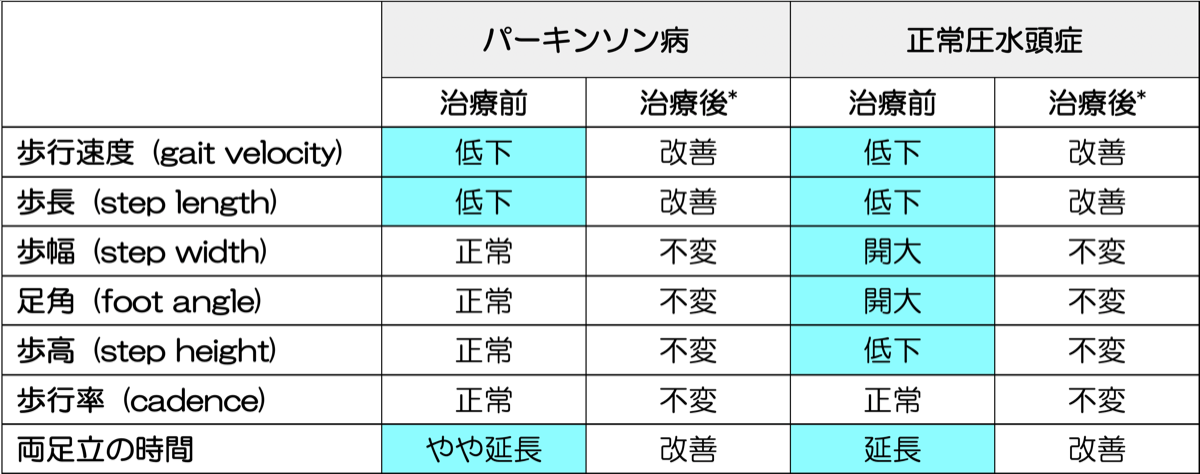
*; パーキンソン病ではL-dopaの内服、正常圧水頭症ではspinal tappingにりる効果。
歩行率;一定時間の歩数
パーキンソン病では視刺激で歩長が正常近くに改善、音刺激で歩行率が正常近くに改善。NPHでもこれらの外部刺激で少し改善が見られる。
注;パーキンソン病での小股で歩高の低下(shuffling gait)は症状が進行してから出現する。
Cadenceに関しては、報告によってばらつきが多い。パーキンソン病患者では健常者よりも高いとするメタ解析の報告もある{33436993}。
パーキンソン病の進行を考えるうえで、Braakらが提唱しているステージ分類(S1〜S6)が参考になる。大まかには、延髄の迷走神経背側運動核(S1)から始まり、橋(S2)、中脳(S3)、視床下部(S3)、 マイネルト核(S3)、扁桃体(S3)、海馬(S4)、大 脳辺縁系(S5)、新皮質(S6)と上行性に進行する(図1)。延髄や橋核群の変性はREM期睡眠行動障害(RBD)や複雑幻視、自律神経障害の原因になると考えられる。このステージ分類の合致率は80〜90%にも及ひぶが、あくまでもパーキンソン病の場合であってDLBでは50%程度となる。マイネルト核の障害は脳のアセチルコリンの低下を招くが、DLBのほうがアルツハイマー病よりもマイネルト核の変性が強いと言われている。このことは、DLBにおける記憶の再生障害や認知機能の変動に関係し、また、DLBはアルツハ イマー病より大脳皮質の神経変性が少ないことから、コリンエステラーゼ阻害薬がDLBで効果が高いことの理由とされている。レビー小体は、早期から末梢神経にも病変が出現する。内臓神経叢では食道下部の神経叢に好発し、下部食道括約筋が弛緩しない食道アカラシアの原因となります。パーキンソン病の患者には便秘が多く、これは消化管神経叢の障害によると考えられる。心臓でのMIBGの取り込み低下は心臓交感神経の障害によるもので、運動時の疲労感や起立性低血圧を引き起こします。皮膚にもα-synucleinが蓄積していることが判明しており、皮膚生検が診断に役立たないか検討されている。
DLBの一部はPDD、すなわちBraakのステージVやVIに相当する(上行経路)。しかしながら、パーキンソン徴候よりも認知症が先行する症例もしばしば認められる。筆者の経験でも、アルツハイマー病と考えられていた患者が経過観察中にパーキンソン症状を示してくる場合がある。このような症例では、嗅球から扁桃体を経て大脳や脳幹に病変が広がる経路が考えらる(嗅 球・扁桃体経路)。ここで興味深いのがアミロイドβの存在で、この経路において大脳皮質にアミロイドβが蓄積していると、α-synucleinの病変が側頭葉や前頭葉に広がりやすくなり、認知症を呈してくると考えられる。扁桃体を経由する症例の多くは、アルツハイマー病の病理が混在している。アルツハイマー病から見ると、その 50%近くにα -synucleinの病変が合併しており、かつ、純粋なアルツハイマー病よりも進行が早いと言われている。ちなみに小阪は、DLB てアルツハイマー病理を合併しているタイプ をcommon form、合併していないタイプをpure formに分類している。Common formは認知症が目立ち、発症年齢が70歳前後であるのに対し、pure formは30歳代と若く、早期からパーキンソン症状を呈して進行も早いと言われている。認知症の原因をレビー小体型とするか、アルツハイマー型とするか、病理上で両者に明確な境界はなく、少なくともpure DLBとするには、大脳辺縁系や新皮質にレビー病変が認められ、アルツハイマー病のNFTのBraakのステージもIV程度までとされている。

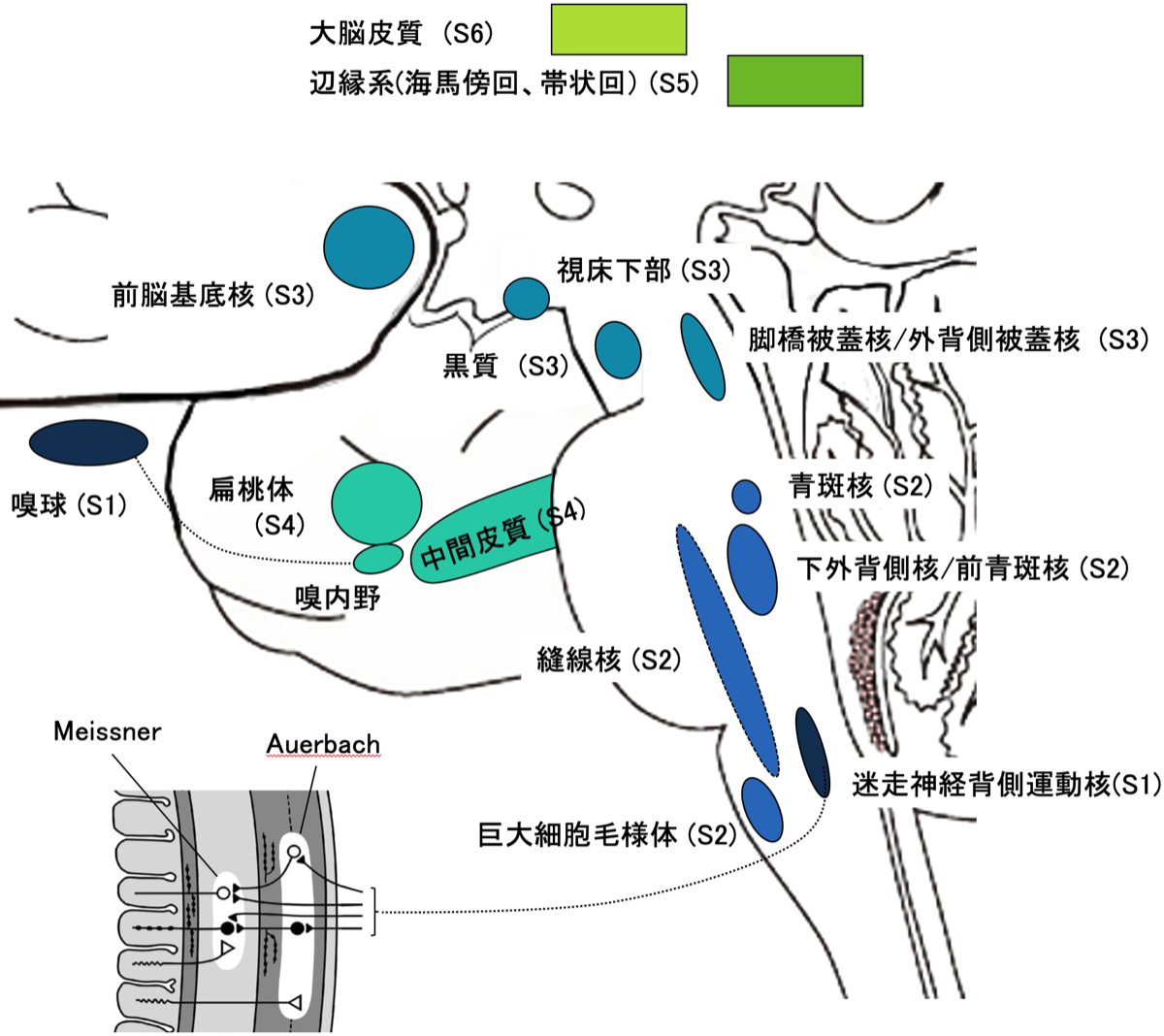
α-シヌクレインの蓄積は延髄の迷走神経背側運動核(DMV; dorsal motor nucleus of the vagus nerve)や嗅球から始まる(ステージ1)。通常のパーキンソン病では、DMVから上行性に進展するのに対し、嗅球経由のものは扁桃体、大脳辺縁系へと進展しやすいと考えられている(dual hit 仮説)。
α-synucleinは神経終末において神経伝達物質の放出の制御に関わっていると考えられちるが、まだよくわかっていない。この遺伝子であるSNCA(4q-21)の異常は常染色体優性遺伝のPDを引き起こすことから、α-synucleinがレビー小体病と何らかの関係があることは間違いない。
軸索の終末にはシナプス小胞が蓄えられている。一部の小胞は軸索終末のactive zone にドッキングしており、瞬時に神経伝達物質を放出できる状態になっている。ドッキングからプライミングにはsynaptobrevin-2 (vesicle-associated membrane protein 2; VAMP2)、syntaxin-1、SNAP-25 (synaptosomal-associated protein 25) のタンパク群が関与してしている。このタンパク群はSNARE複合体 (soluble NSF attachment protein receptor complex) と呼ばれる。まだ詳細は不明であるが、Munc18やmunc13、complexinがSNARE複合体に作用するとzipperingが起きてプライミングと呼ばれる状態になる。活動電位によりCa2+ が流入するとsynaptotagminがセンサーとして働き、シナプス小胞がactive zoneの膜に融合し、小胞内の神経伝達物質がシナプス間隙に放出される。放出後、小胞膜はシナプス前膜に取り込まれて再利用される。軸索の終末に単体として遊離しているα-synucleinはシナプス小胞膜に結合してsynaptobrevin-2に作用してSNAREタンパク群の集合を助けると考えられている。何らかの理由でα-synucleinが重合してoligomerを形成すると、これらの過程が障害されてシナプスは機能不全に陥ります。ボツリヌス毒素やテタヌス毒素はSNAREタンパク群を破壊することにより神経伝達物質の放出を阻害することが知られている。
通常α-synuclein はlysosomeのchaperone-mediated autophagy (CMA)というメカニズムで分解されるが、何らかの理由でα-synucleinの過剰生産、あるいはSNCA遺伝子の異常によりその構造が変化するとα-synucleinがCMAで分解しきれずに細胞内に蓄積する。蓄積したα-synucleinはCMAシステム(lysosome)に負荷をかけ、その他の不要なタンパク質の分解も阻害することになると思われる。ゴーシェ病(Gaucher’s disease)は常染色体劣性遺伝する疾患であるが、遺伝子異常がヘテロの(従って発症しない)場合でも、パーキンソン病の発症リスクが通常よりも5倍高いと言われている。ゴーシェ病はグルコセレブロシダーゼというlysosomeの酵素の異常によりグルコセレブロシドが体内に蓄積する疾患であるが、lysosomeへのストレスが間接的にα-synucleinの分解を障害していると考えられている。また、過剰なα-synucleinはGSK3βを介してタウのリン酸化を促進すると言われている。神経終末の過剰なα-synucleinはexocytosisによってシナプス間隙に放出、後シナプスに取り込まれてドミノ倒しのように神経細胞を障害すると考えられている。
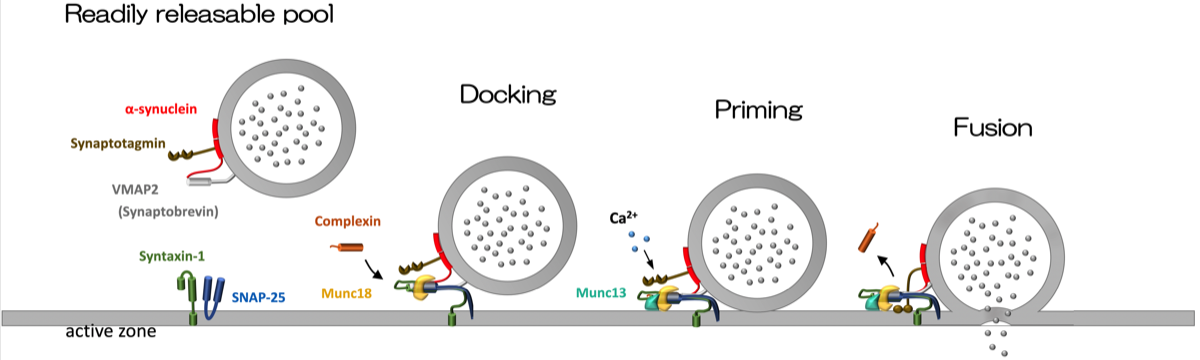
神経終末の細胞膜には active zoneと呼ばれる領域があり、シナプス小胞はドッキングされた状態になっている。ドッキングには小胞膜上のSNAREであるVMAP2とactive zone側のSNAREであるsyntaxin-1とSNAP-25が集合し、これにmunc13やRab3、munc18、complexinが作用してSNARE complexの形状が変化してzipperingが起きてプライミングの状態となる。活動電位によりシナプス内にカルシウムが流入するとsynaptotagminの構造が変化し、complexinが外れてシナプス小胞膜がactive oneに融合して神経伝達物質が放出される。α-シヌクレインはVMAP2に結合してSNAREタンパク群の作用を補助するが、α-シヌクレインが過剰になりオリゴマーを形成すると逆に阻害する可能性がある(22014436 )。
DLBは薬剤での治療介入で効果が得られるので、症例ごとに適切な治療法を実施する必要がある。パーキンソン病の症状が軽度(日常生活に支障がない、Yahr 2度まで)の場合にはガランタミン、ドネペジル、リバスチグミンのようなコリンエステラーゼ阻害薬が推奨されている。これらの薬は幻視、妄想、不安、行動異常に有効と思われる。一方、メマンチンの使用は幻視や妄想の悪化が報告されているので注意が必要。十分な効果が得られない場合には、抑肝散や非定型抗精神病薬(リスペリドン、クエチアピン、オランザピンなど)を投与するが、非定型抗精神病薬の高齢者への使用は死亡率を1.6倍高めると言われていることもあり、抑肝散を第1選択とすることが多い。オランザピンとセロクエルは糖尿病を悪化させる可能性があるので既往歴の確認が必要でとなる。
パーキンソンの症状が目立ってきたら、L-DOPAやアマンタジンの投薬を開始する。パーキンソン病ではドーパミンに対して相対的にアセチルコリンが増加している場合があり、コリンエステラーゼ阻害薬を継続すべきかどうか考慮する必要がある。ドーパミンアゴニストの使用はせん妄や認知機能の低下が誘発される場合があり、基本的にはL-DOPAやアマンタジンが第1選択になる。L-DOPAをドパミンに分解する末梢性ドパ脱炭素酵素(DDC)が血中や消化管に多く存在するため、実際にはL-DOPAとDDC阻害剤との合剤(メネシット、マドパー、イーシードパールなど)が使われる。長期間の投与で、L-DOPAの効果時間が短くなってしまった場合(wearing off)には、DDC以外にドパの代謝に関わるcatechol-O-methyltransferase (COMT)を阻害するコムタン(エンタカポン)を併用する。
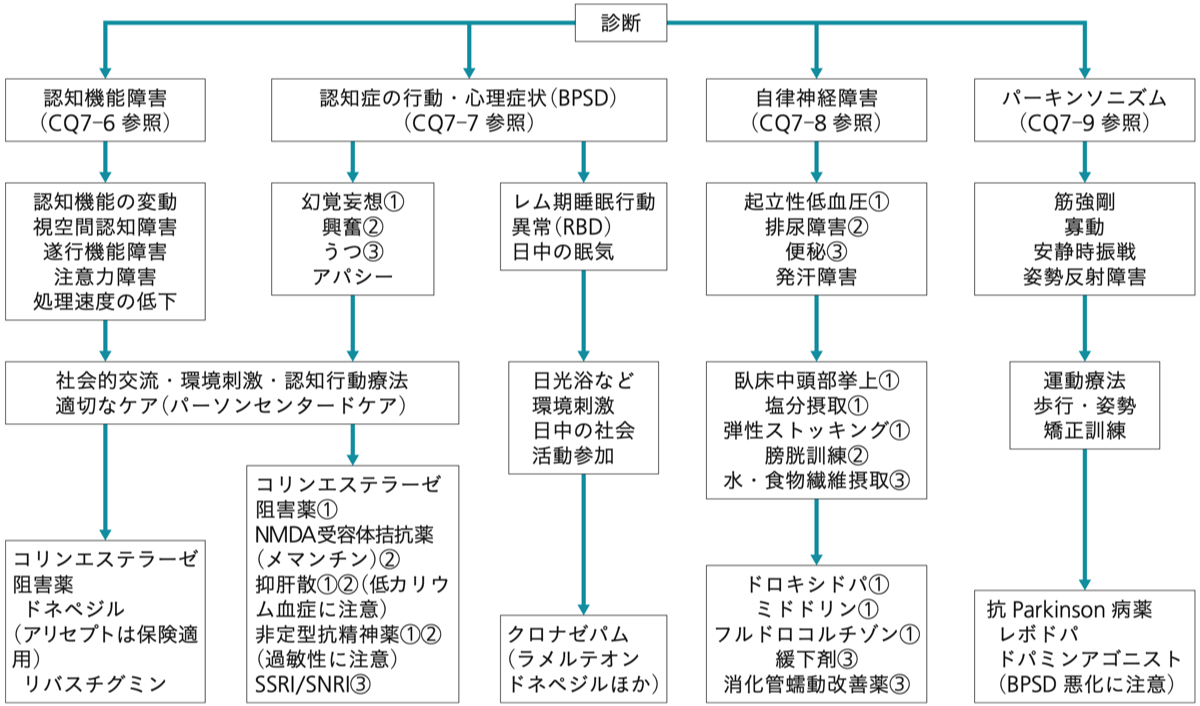
(日本神経学会、認知症疾患診療ガイドライン、2017より)
L-DOPA製剤は半減期が短いので、分割投与が基本である。血中濃度を安定化させるために、徐放剤であるビ・シフロール(プラミペキソール)やレキップ(ロピニロール)、ニュープロパッチ(ロチゴチン)などが使われる。
L-DOPAの増量によりBPSD(妄想、幻覚、興奮など)の悪化やせん妄が強くなる場合には、ゾニサミド (保険適応上はトレリーフ)を1日25mg、wearing offに対しては50mgを内服させる場合もある。
幻覚や妄想がコリンエステラーゼ阻害剤でコントロールできない場合には、非定型向精神薬を使う。メマンチンも興奮を抑える効果がある。
RBDに対してはクロナゼパム(リボトリール)の就寝時服用が推奨されている。
便秘に対して酸化マグネシウムを使っているとL-DOPAの体内への吸収が抑制されてしまうことがありますので注意する必要がある。
うつ症状に対しては、SSRIやSNRIが推奨されている。三環系抗うつ薬は抗コリン作用があるので、使用は避けるべきとされている。
起立性低血圧に対しては、ドロキシドパ、ミドドリン、フルドロコルチゾンを使う。
専門医のための認知症テキスト
認知症関連ページ