はじめに
認知症の原因には、アルツハイマー病を代表とする変性疾患の他、特発性正常圧水頭症、慢性硬膜下血腫、脳腫瘍、脳梗塞、感染、代謝異常、精神疾患などがあるが、ここでは主に変性型認知症を中心に扱う。「認知症」とはあくまでも脳高次機能に対する症候学的な定義であり、その評価には種々の心理機能検査を組み合わせた心理検査バッテリーが必要であることを明記しておく。軽症例や認知症のタイプによってはMMSEなどの簡易検査で27〜28点であっても「認知症」は存在する。心理学的側面の評価は変性型認知症の分類にも有用で、さらには軽度認知障害(MCI)やそのサブタイプ、pre-MCIなど発症前診断にも必要である。MCIやごく初期の認知症では患者が何となく異常を自覚して来院することがあり、自覚的健忘症、うつ病、てんかんなどを考慮して鑑別を進める必要がある。患者の置かれている生活環境の把握や家族を含めた周囲とのかかわり、病状の経過など注意深い現病歴の聴取が必要となる。また、歩行や姿勢反射、関節の固縮などの神経学的所見も重要で、画像検査はあくまでもこれらの所見の裏付けであることに留意したい。
認知症の定義
慢性あるいは進行性の脳疾患によって生じ、記憶、思考、見当識、理解、計算、学習、言語、判断等多数の高次脳機能(認知機能)の障害からなる症候群。ICD、DSM、NIA/AAなどから診断基準が発表されている。どの診断基準にも具体的な指標はないが、記憶力を含めた高次脳機能が年齢や学歴で補正した上で健常者よりも著しく低下(< 1.5〜2.0標準偏差)しており、それが意識レベル(脳幹の機能)の低下によらないものと解釈される。
一般的には、認知機能の低下により日常生活に支障があるかどうかで判断される。日常生活では支障ないが、職場など日常生活よりも高い認知機能が要求される環境下で支障が出てくる場合は、軽度認知障害(MCI)の可能性が高い。薬の内服、お金の管理、買い物、着替え、入浴、食事の支度など日常の生活レベルで支障がある場合は、認知症が疑われる。
Aducanumabがアミロイドβに対する疾患修飾療法(DMT)としてFDAの承認を得たことから、今後は認知症診断よりもバイオマーカを用いた生体病理(in vivo pathology)診断が重要になってくると思われる。認知機能に異常はないが、アミロイドPETで陽性、タウPETでもADの病理と矛盾しない、preclinical ADやMCIレベルのprodromal AD (MCI due to AD)の診断により、早期からのDMTにより認知症への進行が抑制されることが期待される。
DSM(diagnostic and statistical manual of mental disorders)-Vによる認知症の診断基準(2013年)
A . 1 つ以上の認知領域(複雑性注意,遂行機能,学習性および記憶,言語,知覚—運動,社会的 認知)において,以前の行為水準から有意な認知の低下があるという証拠が以下に基づいている:
(1) 本人,本人をよく知る情報提供者,または臨床家による,有意な認知機能の低下があったという懸念,および
(2) 可能であれば標準化された神経心理学的検査に記録された,それがなければ他の定量化された臨床的評価によって実証された認知行為の障害
B . 毎日の活動において,認知欠損が自立を阻害する(すなわち最低でも,請求書を支払う,内服薬を管理するなど,複雑な手段的日常生活に援助を必要とする)
C .その認知欠損は,せん妄の状況でのみ起こるものではない
D .その認知欠損は,他の精神疾患によってうまく説明されない(例: うつ病,統合失調症)
☞ 手段的日常生活(Instrumental ADL)
高齢者の認知機能低下では、複雑な動作であるIADLの障害の方がADLの障害よりも先行して目立つようになる。
ADL
食事、トイレ、入浴、洗面(整容)、着替え、入浴、移動など
IADL
電話(使い方)、リモコンの操作、買い物、バスなどの利用、料理、洗濯、金銭の管理、服薬の管理など
ICD10による認知症の診断基準(1993年)
G1. 以下の各項目を示す証拠が存在する。
(1) 記憶力の低下 新しい事象に関する著しい記憶力の減退。重症の例では過去に学習した情報の想起 も障害され、記憶力の低下は客観的に確認されるべきである。
(2) 認知能力の低下 判断と思考に関する能力の低下や情報処理全般の悪化であり、従来の遂行能力水 準からの低下を確認する。
(1)(2)により、日常生活動作や遂行機能に支障をきたす。
G2. 周囲に対する認識(すなわち、意識混濁がないこと)が、基準G1の 症状をはっきりと証明するのに十分な期間、保たれていること。 せん妄のエピソードが重なっている場合には認知症の診断は保留。
G3. 次の1項目以上を認める。
- 情緒易変性
- 易刺激性
- 無感情
- 社会的行動の粗雑化
変性型認知症の分類
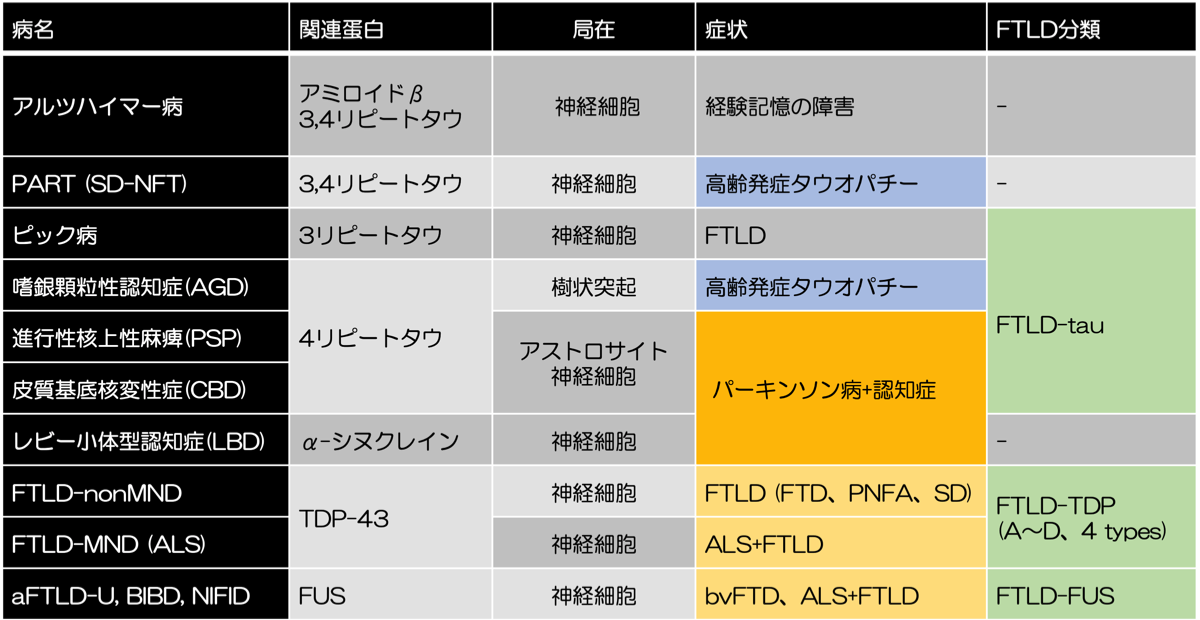
変性型認知症の発症機序は明らかにはなっていないが、病理検査で疾患に特徴となる蛋白マーカーによる分類は病態を反映している可能性があるため理解しやすい。タウ蛋白は神経細胞の軸索の骨格や輸送に関係する微小管に結合してこれを安定化する蛋白で、微小管へ結合する領域の数によって3R(リピ-ト)と4Rに分類される。胎生期には3Rタウのみが発現しており、成人になるにつれて4Rタウの割合が増えてくる。タウ蛋白がリン酸化され重合するとタウオパチーを引き起こすと思われる。神経終末からの神経伝達物質の放出にはSNARE蛋白群が重要な役割を担っているが、α-synucleinの異常はこの放出機構を障害しパーキンソン病を発症すると考えられている。TDPとFUSはpre-mRNAのsplicingを抑制してタンパク合成の制御をしているが、前頭側頭型認知症や筋萎縮性側索硬化症の発症に関係していると推測されている。下表に原因別変性型認知症の分類を示す。
細胞は不要となった蛋白質の除去を行う様々な機構をもつが、これが破綻しても生まれ変わることで代償することができる。しかしながら神経細胞は、他の細胞と異なりほぼ寿命と同じ時間生きているため、加齢とともに不要な蛋白質が沈着しても耐えるしかない。興味深いことに、認知症の原因を調べると認知症(=大脳の神経細胞の障害)に限らず、ALSなど神経変性疾患には共通した原因-蛋白質の立体構造に基づく重合化とそれがもたらす細胞障害性のメカニズムが垣間見えてくる。
変性型認知症の病態別分類表
認知症関連ページ
SD-NFT: senile dementia of the NFT type (神経原線維変化型老年期認知症)、PART; primary age-related tauopathy, MND: motor neuron disease(運動ニュ-ロン疾患)、aFTLD-U: atypical FTLD with ubiquitin-positive inclusion、BIBD: basophilic body disease(好塩基性封入体病)、NIFID: neuronal intermediate filament inclusion disease(神経細胞性中間径フィラメント封入体病)
アストロサイトのタウ病変は、PSPではtufted astrocyte, CBDではastrocytic plaqueとして認められる。
*パーキンソン症候はFTLD-tau以外のFTLDの症例でも認められる。