7. 脳血管性認知症
血管性認知症(vascular dementia, VaD)は脳卒中後の高次脳機能障害の総称であるが、神経臨床医にとってはあくまでも脳梗塞や脳出血にともなう後遺症ということで、血管性認知症という診断名を意識することは少ないと思割れる。よく用いられるNINDS-AIRENによる基準では、血管性認知症は1)multi-infarct dementia(多発脳梗塞性認知症)、2)視床前部などのstrategic infarction (局所病変型梗塞認知症)、3)subcortical ischemic vascular dementia (SIVD;皮質下血管性認知症)あるいはsmall vessel disease with dementia(小血管性認知症)に分類される。このうち1番目の多発脳梗塞性認知症(図;皮質型とも呼ばれる)と2番目のstrategic infarctionは、臨床的にはやはり脳梗塞としての扱いになると思割れる。3番目のSIVDの診断には注意が必要であり、変性型認知症や特発性正常圧水頭症との鑑別に苦慮する場合がある。27カ国のDelphi法によるvascular impairment of cognition classification consensus study (VICCCS)では、血管性認知症を、1)SIVD、2)multi-infarct あるいは cortical dementia、3)post-stroke dementia (PSD)、4)mixed dementiaの4タイプに分類している{29446769}。参考までにO’Brienの分類を表に示す{26595643}。
アルツハイマー病(AD)の患者にラクナ梗塞があっても、必ずしも混合型認知症とは言えない。血管性認知症と言うからには、ラクナ梗塞などの脳血管由来の病変が認知機能の低下に直接影響している場合になります。ラクナ梗塞はしばしば無症候性のこともあるので、このあたりをどのように判断すべきかは難しい。NACC(National Alzheimer’s Coordinating Centre)による5715例の剖検による調査では{23842566}、ADの32%に何らかの脳血管障害(CVD)をともなっていたが、病理では80%にvascular pathology(脳梗塞、ラクナ梗塞、微小脳梗塞、白質病変、脳出血などの小病変)を合併していた。認知症やCVDのなかった健常者のvascular pathologyは67%で、これらの小病変はADの発症を促進する可能性がある。また87例の剖検の検討では{9588373}、臨床的に血管性認知症と診断されていた13例中、純粋な血管性認知症は1例もなく、6例はAD、6例はAD+血管性認知症、1例はパーキンソン病にCVDを伴っており、血管性認知症という疾患の独立性を疑う結果であった。
病理学的にはADとの合併が多くその独立性が疑われたことのある血管性認知症であるが、SIVDと思われる症例はADとは明らかに異なる症状を示す。アパシーやうつ病のような意欲の低下、注意・集中力の低下、計画の作成や遂行力の低下、起立-歩行障害など、ADの主体である記憶力の低下よりも、いわゆるfrontostriatal circuitの障害が目立つ。FDG PETでは前頭葉、線条体、視床の代謝低下が見られる{23043907}。PiB PETでアミロイドβ陽性のAD(61例)と陰性のSIVD(44例)、健常者(51例)で認知機能検査(Seoul Neuropsychological Screening Battery, SNSB)の成績を比較した結果、ADはSIVDよりも言語性と視覚性記憶が低下していたのに対し、SIVDはADよりもphonemic fluency (verbal fluency testで音韻のもの、例えば「さ」で始まる単語を1分間で出来るだけ多く言わせる)とストループ試験(Stroop test)の成績が悪かった{23325910}。ただし、どちらのグループも健常者と比較してSNSBのすべての項目で有意な低下があり、個々の症例をこのバッテリーだけで判別するのは困難であった。またSIVDでは海馬の萎縮も認められるので、海馬の萎縮の有無でADとの鑑別はできない{21708443}。SIVDの診断は、ADなど認知症をきたす変性疾患が除外でき、思考や動作が遅い、計画・遂行力の低下、鬱やアパシーなど前頭葉を中心とした高次脳機能障害、歩行障害、構音障害やパーキンソニズム、錐体路徴候などがあり{23325910}、MRIで小血管病変が認められること、また、高齢であること、高血圧、糖尿病、心疾患、高脂血症、喫煙などの危険因子の存在などから行う。
☞ Frontostriatal circuit
基底核(basal ganglia)は脳深部の灰白質領域で、大脳皮質と視床や脳幹との間で神経回路(ループ)を形成している。主なものに線条体(新線条体、背側線条体)、淡蒼球、視床下核、側坐核、嗅結節、マイネルト基底核、黒質注1がある。基底核が形成する神経回路には大脳皮質の運動関連領域から背外側線条体(≒被殻)に入る知覚運動系回路(sensorimotor circuit)、前頭前野や頭頂葉などの連合野から背内側線条体(≒尾状核)に入る連合系回路(associative circuit)、眼窩前頭皮質や腹側前頭前野、前部帯状回、島回などから腹側線条体(≒側坐核)に入る辺縁系回路(limbic circuit)がある{16715055}。知覚運動系回路は外界からの情報に対する行動決定やオペラント条件づけ(学習による条件反応)にかかわっている。連合系回路は見当識、注意、アフォーダンス(環境から学び適応する)、ワーキングメモリなどに関与している。辺縁系回路は報酬のための動機付けや行動決定に関係している。基底核の障害は運動失調の他に、統合失調症、強迫性障害、薬物依存、うつ病などの精神疾患に関係している。
注1:黒質は中脳(脳幹)に位置するが線条体との関わりが強く、基底核として扱われることが多い。
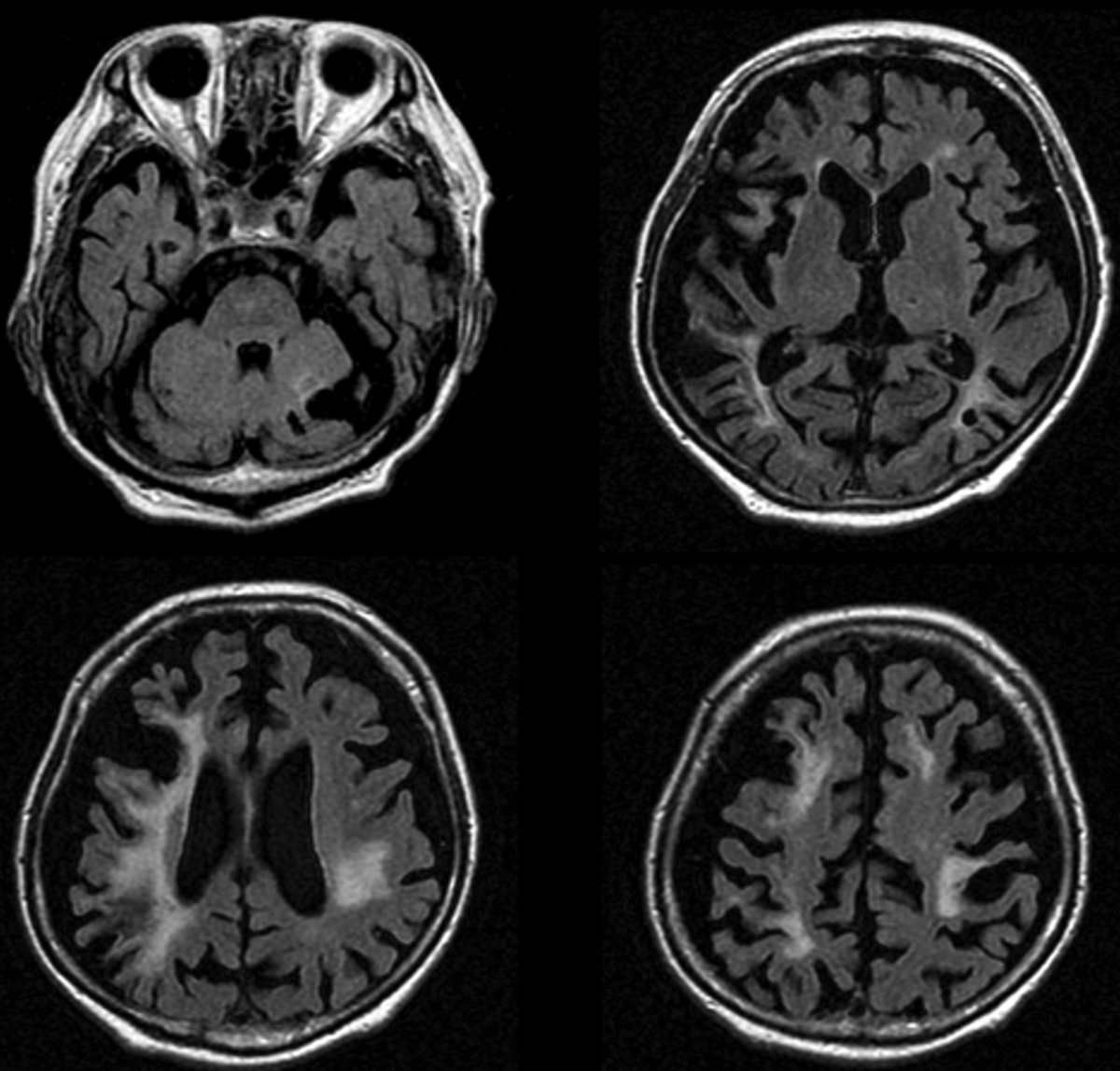
脳小血管の病変による皮質下の灰白質や大脳白質の血管性障害により認知機能が低下する疾患。SIVDにおける皮質下病変とは、主に線条体などの基底核、視床、大脳白質、海馬、脳幹の血管性病変で、これらの領域の機能不全による症状が認められ、MRIでは多発性のラクナ梗塞や白質病変、脳萎縮が目立つ。小血管の病変が原因で、画像上大きな病巣は認めらない。小血管とは、小動脈と細動脈、さらには毛細血管から細静脈になる。小動脈と細動脈の中膜平滑筋は抵抗血管として作用し脳血流量の調整(autoregulation)に関わっている。脳実質を穿通後に小動脈(small artery)から細動脈(arteriole)に変わり、細動脈では内弾性板の連続性が失われ平滑筋が直接血管内皮に接触し、外膜は軟膜とくも膜で構成されている。病的な小血管には、中膜平滑筋の消失、lipohyalinosisやfibrinoid necrosis、microatheroma、血管壁の肥厚と内腔の狭窄が認められる。このような脳の小血管の病変は、腎臓や網膜にも共存することが多く、しばしば尿に微量アルブミン(尿試験紙ではタンパク陰性)の漏出、網膜症などが合併する。小血管の病変には、加齢、糖尿病、高血圧が関与し、特に高血圧が重要な危険因子となる。他にmicroatheromaによる穿通枝閉塞やmicroaneurysmによる脳出血、脳アミロイドアンギオパチー(cerebral amyloid angiopathy, CAA)も小血管の病変になる。
小血管病変は完全梗塞と不完全梗塞(incomplete infarction)に分類されることがある。完全梗塞とは虚血部脳実質に壊死が認められるもので、しばしば壊死部が空洞となり、ラテン語で空洞を意味するラクナ(lacuna)梗塞と呼ばれる。これよりも小さく肉眼的な空洞を作らない、顕微鏡でのみ見つけられる梗塞は微小梗塞(microinfarcts)と呼ばれる。病理で微小梗塞が発見される頻度は多く、健常高齢者でも1/3に見つかると言われている{21825242}。原因に定説はないが、基底核や大脳白質などの穿通枝終末部に好発することから、少なことも一因に動脈硬化に伴う動脈原性塞栓症(A to A embolism)による微小塞栓(microemboli)の可能性が指摘されている{30744544}。微小塞栓は急性期にはMRIの拡散強調画像で確認できるが、慢性期には空洞形成を確認できないため、白質病変の少なくとも一部は微小塞栓によるものと考えられている。3TMR装置でdouble inversion recovery法による撮像で慢性期の微小梗塞がhigh intensityとして描出されるとする報告がある{22607584}。
不完全梗塞とは壊死巣の形成はなく、小血管壁の肥厚と内腔の狭窄(hyalinized vessels)に伴うオリゴデンドロサイトの消失、ミエリンの消失、軸索の損傷、グリオーシス(astrogliosis)、アストロサイトの突起の破壊(clasmatodendrosis )などを言う。これらの所見は、MRIで脳室周囲白質病変や深部白質病変の領域に認められ、しばしば小血管の周囲には血管周囲腔の拡大(spongiosis)を伴う。抵抗血管である小動脈や細動脈の平滑筋が脱落しており、自動調節能(autoregulation)の障害に伴う慢性虚血、血管内皮の損傷に伴う血液脳関門の破綻、血管周囲にフィブリンやアルブミンの漏出が起こると考えられている。また、白質病変(特に脳室周囲)の原因に、細静脈のvenous collagenosisを重視する報告がある{28431180}。
SIVDはラクナ梗塞が複数認められるlacunar state (état lacunaire)と白質病変を主体とするビンスワンガー病(Binswanger’s disease)に分類されるが{12849365}、これらはサブタイプとしての位置づけではなく、どちらがより目立つかというものになる。白質病変の重症度と認知機能の低下には相関が認められるが、ラクナ梗塞の数の方が白質病変のグレードより強い相関がある。秋口らは病理でビンスワンガー病と診断した症例のMRIの検討で、白質病変の程度が強いほど、かつ、ラクナ梗塞の数が多いほどビンスワンガー病である可能性が高いと結論している{25493272}。
脳アミロイドアンギオパチー(cerebral amyloid angiopathy, CAA)は、主に小動脈から細動脈の血管壁にアミロイドβ1-40が沈着している状態。CAAはAD発症の危険因子とされ{3415200}、脳梗塞、微小出血、脳出血、脳表ヘモジデリン沈着症(cortical superficial siderosis)、血管炎の原因となる。高齢になるほど有病率が増加し、60歳以上では10〜50%、90歳以上では70%に認められ、ADではその率が高くなり80〜90%に認められる。アポリポ蛋白Eのε4とε2アリルは脳アミロイドアンギオパチーの危険因子と言われている。また、脳アミロイドアンギオパチーは、海馬の微小梗塞との関連性が報告されている{29574591}。
常染色体優性遺伝する疾患で、NOTCH3遺伝子のミスセンス(missense)変異(塩基配列の変異)によって全身の小血管の中膜にgranular osmiophilic material (GOM)が蓄積し、40歳頃からMRIや神経症状でSIVDを呈してくる。ただし高血圧を伴うことは少ない。稀な疾患で日本では200人程度の報告がある。若い時から前兆のある片頭痛が先行していることがあり(50%)、中年期になると繰り返すラクナ梗塞や微小出血、進行性の白質病変が出現する。白質病変は20歳代でも出現する。白質病変が通常ではあまり認められない側頭葉の先端部にも出現している場合は本疾患を疑う。興味深いことに、特徴的な側頭極の白質病変が目立つかどうかは患者の民族的背景に依存しており、アジア系の患者では少ない。確定診断にはNOTCH3遺伝子変異を確認するか、皮膚生検でGOMあるいは抗notch3抗体陽性の凝集物の存在を確認するす。55歳以下でSIVDの症状や画像所見があり、家族歴(優性遺伝ですがはっきりしない場合もある)があれば、本疾患を疑い検査を進める。
Notchレセプターは1回膜貫通蛋白で、図のように血管内皮と平滑筋の細胞間シグナリングに関わっている。現時点でヒトでは4種類のNotchが見つかっている。Notchレセプターは、細胞外ドメイン(Notch extracellular domain; NECD)と細胞内ドメイン(Notch intracellular domain; NICD)からなり、CADASILを引き起こすNOTCH3の遺伝子異常は全てNECDに存在する。この領域ではシステイン結合(S-S)が立体構造の形成に重要で、CADASILではシステインが他の残基に変化して一部のS-S結合ができずに立体構造が変化すると考えられている。GOMは平滑筋周囲の細胞外にオスミウム陽性の顆粒として認められ、少なくともこの中にはNECDが含まれている。この凝集体が何らかの機序で小血管に異常をもたらすという説(gain of toxic function)が有力であるが、Notchシグナルのloss of functionによる平滑筋の障害の可能性も指摘されている。事実、GOMが出現しない遺伝子変異の症例の報告がある{26216120}。
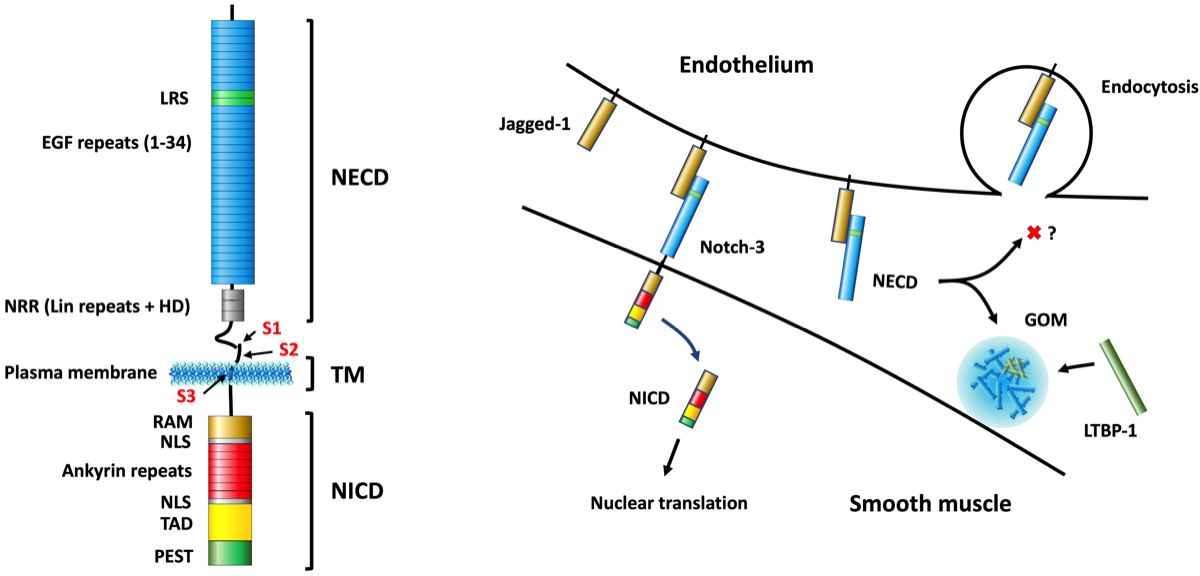
Notch3の前駆体はGolgiでfurinによって切断(s1)され、NECDとTM-NICDに分離される。NECDとTM-NICDは糖鎖による非共有結合であるヘテロ二量体を形成して細胞表面(平滑筋細胞)の膜に輸送される.Notchが血管内皮細胞から出ているリガンドに結合すると、ADAMによって切断され(S2)NECDと分離される。次にγ-secretaseにより切断され(S3)、NICDが細胞内に遊離して核に運ばれ100以上にも及ぶ転写が発動される。血管内皮のリガンドであるJagged-1と平滑筋のnotch1は平滑筋の増殖、notch3は平滑筋の成熟を促すと推測されている.。
NECD:notch extracellular domain, TM:transmembrane domain, NICD:notch intracellular domain, LRS:ligand recognition site, NRR:negative regulatory region, HD:heterodimerization domain, RAM:RBP Jκ associated module, NLS:nuclear localization sequences, TAD:transactivation domain, PEST:proline-glutamic acid-serine-threonine rich motif, GOM:granular osmiophilic material, LTBP-1:latent TGF-β-binding protein.
GOMにはlatent TGF-β-binding protein 1 (LTBP1)が含まれているとする報告がある{25190493}。LTBP-1はTGF-βとlatency associated protein (LAT)複合体をextracellular matrixにアンカーしており、LTBP-1の減少は結果としてTGF-βの働きを強めることにつながります。TGF-βの活性亢進は後述のCARASILでも関係していると言われており、孤発例を含めた小血管病変の原因として、TGF-βの過剰な活動の可能性が指摘されている{28082670}。
常染色体劣性遺伝する疾患で、プロテアーゼであるhigh-temperature requirement A serine peptidase1(HTRA1)の遺伝子のミスセンスや終止コドンへの変異であるナンセンス(nonsense)変異が原因とされている。HTRA1の異常は、他に関節炎や加齢黄斑変性にも関わっている。CADASILより若い30歳代でSIVDの症状を呈してくる。若年性禿頭、腰痛(変形性脊椎症、椎間板ヘルニア)が特徴で、CADASILのような片頭痛との関連は報告されていない。病理では小血管の平滑筋が消失し、中膜は肥厚してヒアリン変性が見られ、fibronectinやfibrillar collagenが減少している。CARASILの原因はHTRA1の活性低下によると考えられているが、HTRA1のノックアウトマウスによる観察では{29768431}、不思議なことに脳の血管には異常が出現せず、むしろ大動脈の平滑筋の増殖が認められている。しかしながら、これらの平滑筋は酸化ストレスに脆弱でアポトーシスを起こしやすく、加齢とともに最終的にはwild-typeよりも血管平滑筋は減少する。また、平滑筋からのMMP-9の産生が亢進しており、これが弾性板(elastic lamina)の破壊やコラーゲンの減少の原因と推測されている。大動脈であることを除けばヒトの脳の小血管に起こる病理所見と矛盾しない結果と思われる。またこの研究では、TGF-βの関与は明らかではなかった。
HTRA1はTGF-βの産生過程でER-associated protein degradation (ERAD) に導いて産生の抑制をするが、HTRA1の活性低下によりTGF-βが過剰に発現すると推測されている。しかしながら、 HTRA1はLTBP-1に作用してextracellular matrixからTGF-βを遊離して活性化するとも考えられ、むしろTGF-βの作用の低下が原因とする研究も報告されている{25369932}。
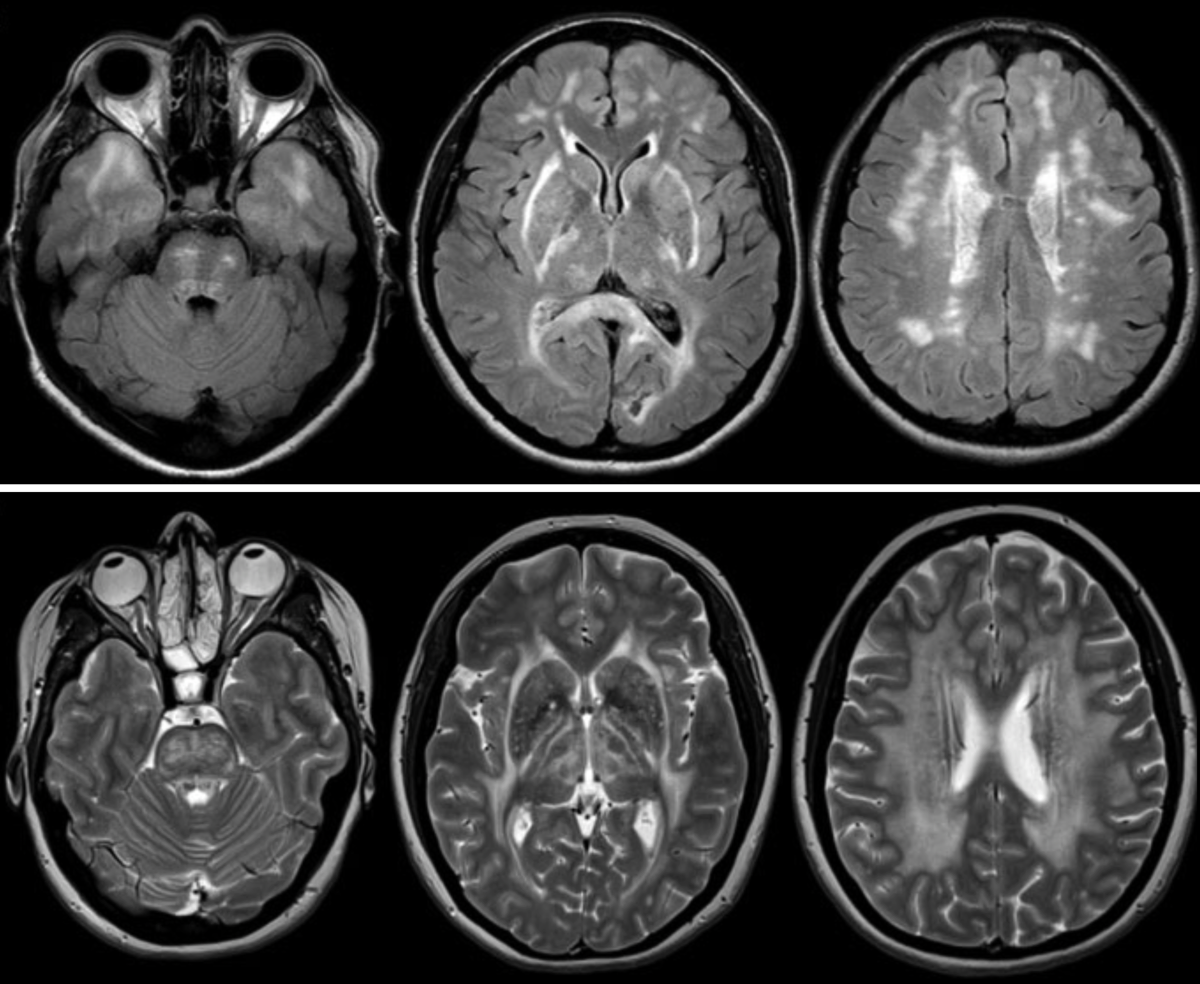
CAAでは小動脈や細動脈壁にアミロイドβが沈着している。毛細血管や細静脈にも出現するが、この場合には程度や頻度は少なくなる。初めは中膜の平滑筋周囲に沈着し、やがて外膜や内膜に及ぶ。進行すると平滑筋が消失するので、内膜側と外膜側にアミロイドβが陽性となるdouble barrel を呈する。この頃にはfibrinoid necrosisやmicroaneurysmも出現してくる。血管周囲の脳実質に微小出血をきたすとMRIのT2*強調画像で微小出血として認められるようになる。CAAは後頭葉、次いで前頭葉の血管に出現しやすく、基底核、視床、脳幹、大脳白質には稀とされている。進行すると大脳皮質以外に小脳にも認められるようになる。
CAAには毛細血管に蓄積するタイプ1と小動脈に蓄積するタイプ2がある。タイプ1はアポリポ蛋白Eのε4が危険因子で、毛細血管の閉塞と脳実質のアミロイドβの沈着、ADとの関連性が強いと言われている。一方、タイプ2はアポリポ蛋白Eのε2が関係している。アミロイドβ1-40は主に神経細胞で産生され細胞外液に排出され、これはアストロサイトを介して血管周囲腔に排出されると考えられている。血管平滑筋の障害は動脈周囲腔の拍動を低下させ、血管周囲腔のアミロイドβ1-40の沈着の原因になる可能性がある。
アミロイドβ1-40はアミロイドβ1-42よりも水溶性であり、ADでは不溶性のアミロイドβ1-42の方が病態として重要。したがって、ADの症例で脳アミロイドアンギオパチーの出現率が高いのは、これがADを起こすのではなく、両疾患に共通した危険因子が存在すると考えられる。
Glymphatic pathway
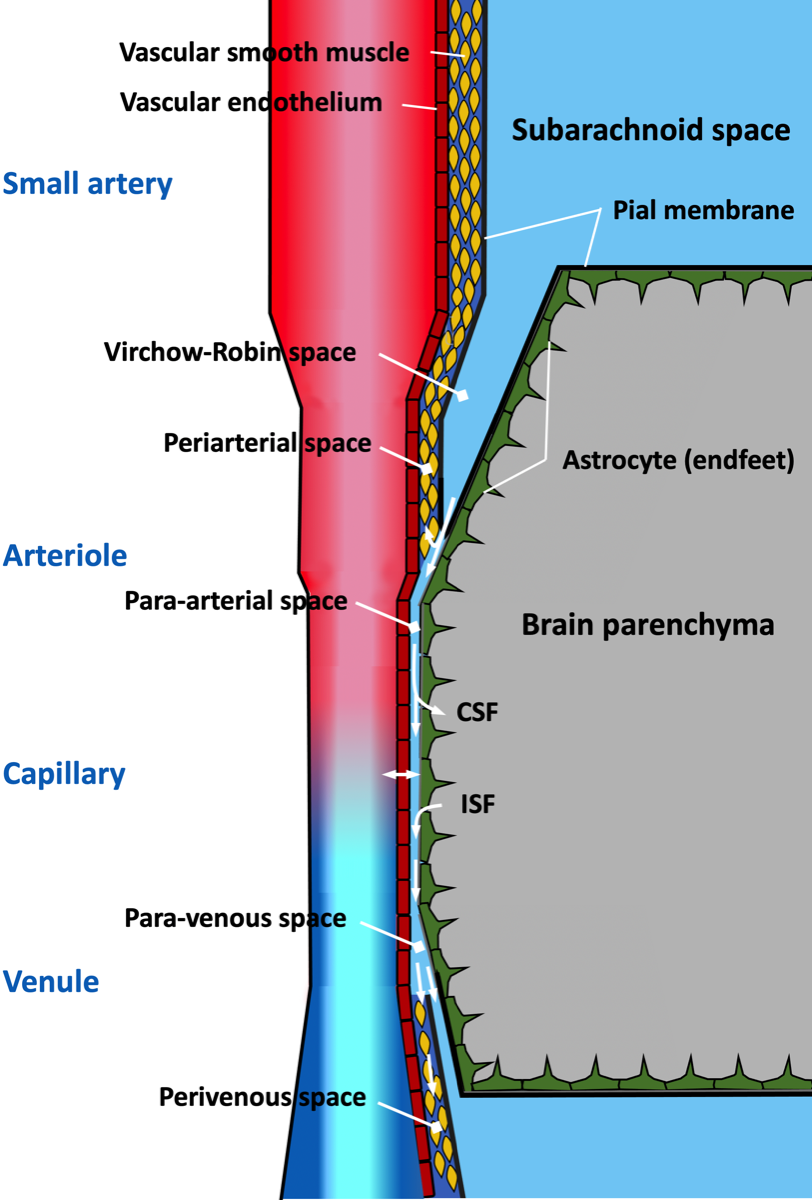
この経路にはparavascular spaceとperivascular spaceが関係している(論文によっては両者を合わせてperivascular spaceと記述している場合がある) (17)。Paravascular spaceはVirchow-Robin spaceの続きで、深部では血管とそれを取り囲むアストロサイトのfootとの間隙になる。この経路は動脈の拍動により間隙の液体を血流と同じ方向に送り、アストロサイトのアクアポリン4レセプターなどを介して脳実質の細胞外間隙へ髄液を流す。脳実質の間質液は静脈側へ流れ、再度アストロサイトを経由して静脈のparavascular spaceに排出される{30353860}。
Perivascular spaceは小動脈や細動脈の中膜の平滑筋の間隙(intramural perivascular space)で、動脈では血流とは逆方向に流れる。Paravascular spaceは毛細血管のレベルでは脳軟膜がなくなり、perivascular spaceと繋がることになる。ヒトの動脈や静脈の中膜から外膜深層にはリンパ管があり{5352857}、perivascular spaceに流れた液体はやがてリンパ管に流れ込むことになる。CAAではアミロイドβが血管中膜へ沈着するが、脳実質からparavascular spaceに排出されたのち、一部がperivascular spaceに流れて貯まると考えられる。睡眠中には間質腔が60%も広がり、アミロイドβなどの老廃物の排出が促進されるとの報告がある{24136970}。またこのようなglymphatic pathwayの機能は加齢によって低下する{25204284}。特発性正常圧水頭症の患者においても、glymphatic pathwayの機能低下が指摘されている{28969373}。
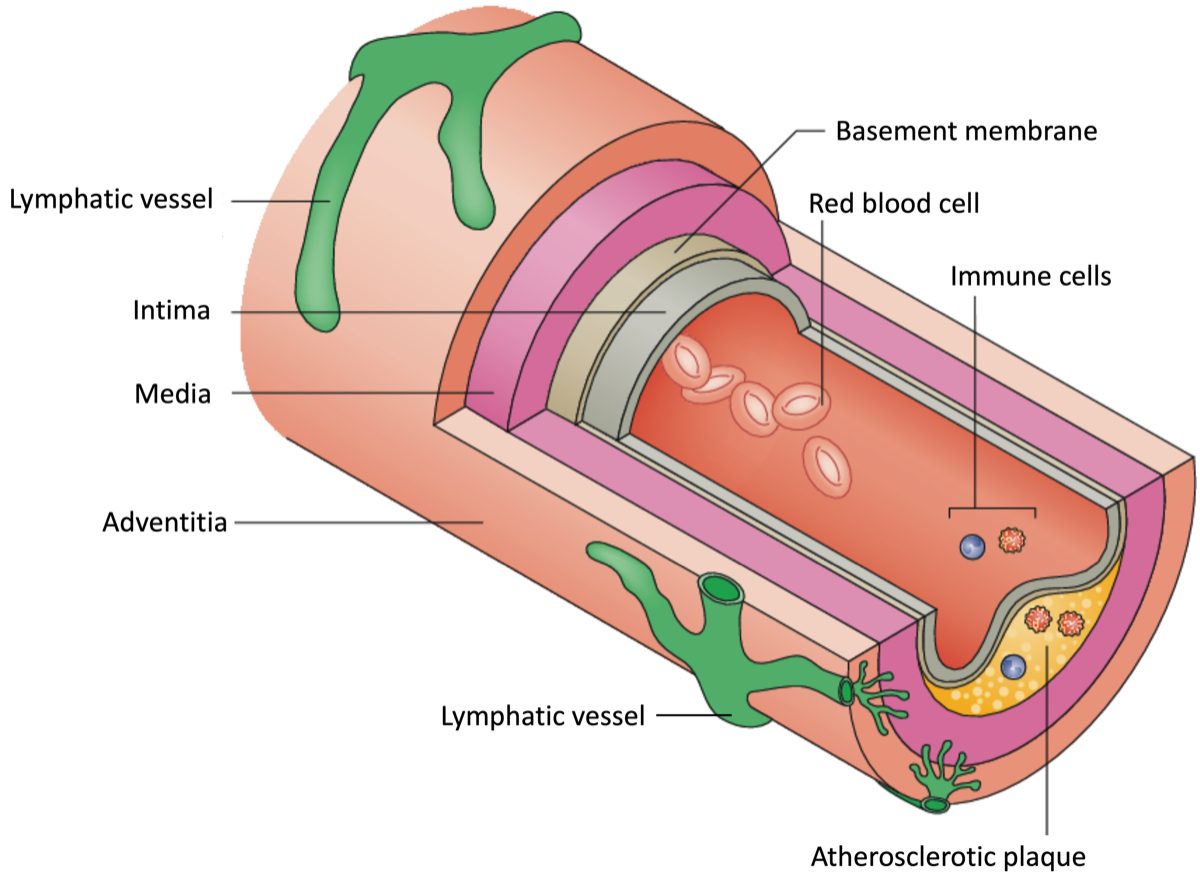
Brakenhielm E. et al. Nat Rev Cardiol, 2019
Meningeal lymphatic pathway
リンパ管内皮の特殊染色の技術の進歩とともに、これまで確認しにくかった硬膜内のリンパ管の存在が明らかにされつつある{26030524}{26077718}。Glymphatic pathwayでperivascular spaceに流れたものは、硬膜のリンパ管にも吸収される。造影MRIでヒトの上矢状静脈洞、直静脈洞、中硬膜動脈近傍にリンパ管が描出される{28971799}。
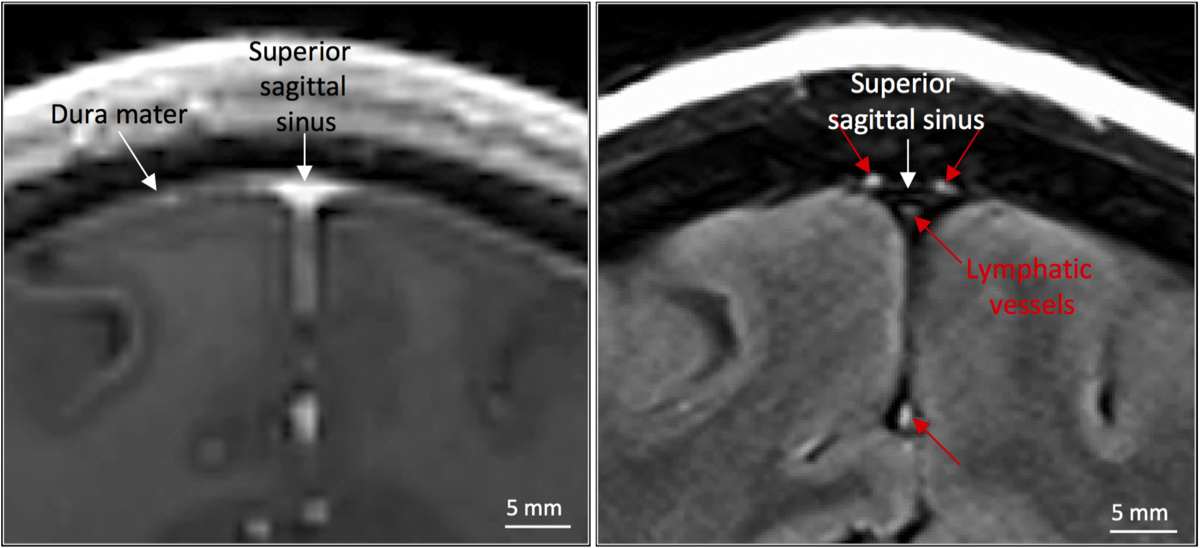
ガドブトロール後の冠状T1強調MRIでは、硬膜(矢印)と上矢状洞や直静脈洞(矢印)を含む血管が拡散して増強されるため、リンパ管を識別することができない。ガドブトロール投与後の冠状T2-FLAIR画像では、硬膜は強調されず、静脈性硬膜洞と平行して大脳鎌内を走るリンパ管(赤矢印)が確認できる。
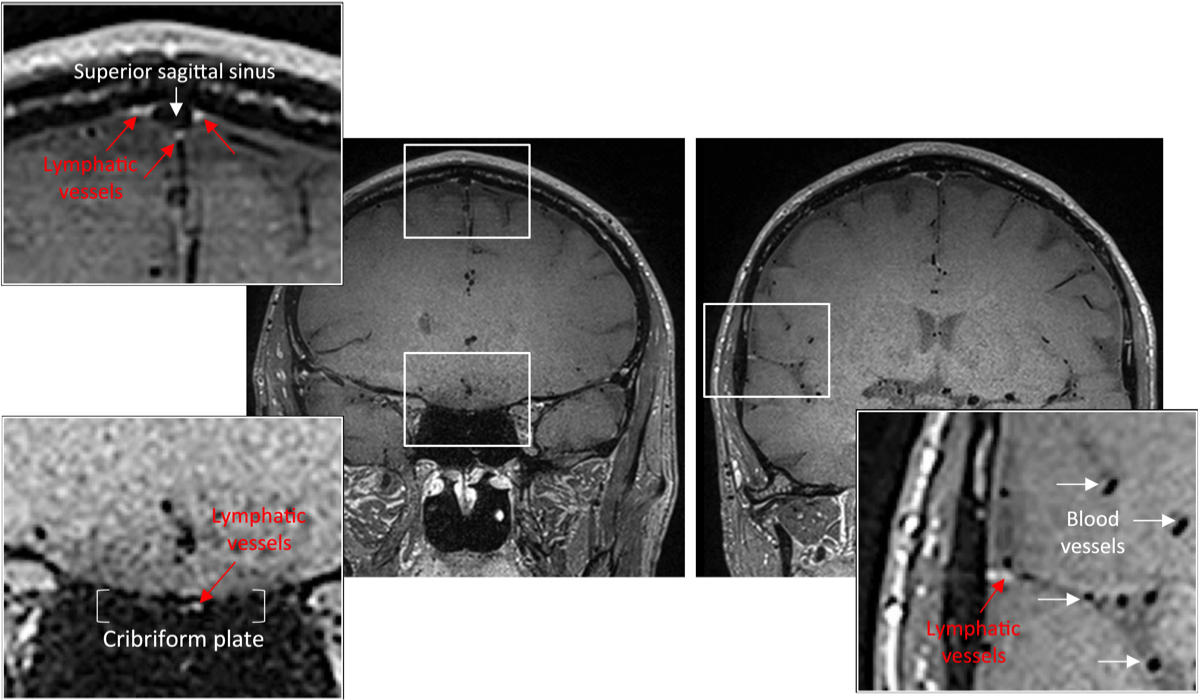
Gd造影剤(ガドブトロール)後の冠状T1強調MRIでは、硬膜リンパ管(拡大表示枠内の赤矢印)がよく識別され、硬膜洞、中髄膜動脈、篩板(白矢印)の周囲に局在していた。
専門医のための認知症テキスト
認知症関連ページ