本研究室では大脳皮質の発生・発達に関わる遺伝
子の機能解析から精神疾患や脳の発達異常の原因について分子的知見を得ることを目的として研究を進めています。その端緒となっているのは勝山がこれまで行ってきたReelin-Dab1シグナ
ルの解析です。小脳及び大脳皮質に形態異常を示す古典的自然発症変異reeler変異マウスの
原因遺伝子がReelinで
す。
これまでにreelerマウスの新
しい表現系の発見(Muraoka et al., 2007;
Katsuyama & Terashima, 2009; Dekimoto et al.,
2010)やReelinの下流で
働いていると考えられる分子の解析(Sonoshita et al.,
2015; Imai et al., 2016)や新規遺伝子の同定(Baba et al., 2006; Takano et al., 2010,
2011)、Reelinシグナルの進化(Imai et al., 2012; 勝山&寺島, 2013)について研究を進めてきました。
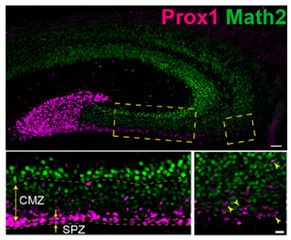
また脳形態形成の研究としては海馬など大脳皮質の中でも新皮質とは異なった形態的特徴
を持 つ領域がどのような細胞移動や分子発現を行って形成されるか組織学的観察を元に調べております(Sugiyama et al., 2013, 2014; Sugiyama
& Katsuyama, 2015; Blume et al., 2017)。
今後は、以下に述べる主な研究テーマを進めて、これら下流因子の分子的な機能や精神疾 患や その他の疾患との関係を明らかにする研究を進めていきたいと考えております。また、細々と脳形態の進化(Katsuyama et al., 1996; 1998; 2002; 2005; 2007; Ohtsuka et al., 2014)についての研究も 再開したいと思っています。
(1)脳
形態形成の発生学的研究
脳は他の臓器と比べても不思議な形をしています。神経細胞は脳室に面した層の神経幹細胞から生じます。
生まれた神経細胞は神経ネットワークを作るべき場所に移動して行きます。この形態形成過程については大脳新皮質で多くの
研究がなされてきましたが、脳の他
の部位については研究が十分でなく、どのように神経核や層構造などの独特の解剖学的形態が作られていくか不明です。さら
には、それぞれのニューロンが神経
繊維をどのように伸ばしてネットワークを作っているかについても、まだまだ調べるべきことがあります。我々は、古典的な
組織学的解析や免疫染色、さらには 遺伝子改変動物を用いた研究を行い(Dekimoto et al., 2010;
Sugiyama et al., 2013; 2014; Blume et al., 2017;
Erkhembaatar et al.,
2022)、脳の複雑な形態を作る発生学的プロセスを明らかにしたいと考えています。
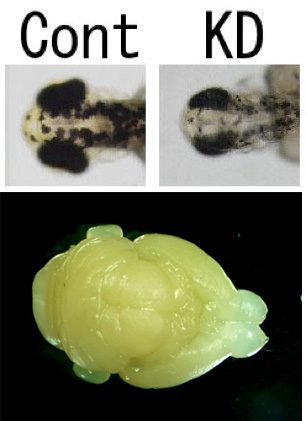
(2)脳の形態形成に関わる新規因子の解析
これまでに脳の形態形成に関わる新規因子の候補といてクローニングしたSbno1を 同定しました(Baba et al., 2006) Sbno1は ゼブラフィッシュを用いた遺伝子ノックダウン(KD)実験によっ て、脳や眼(眼は間脳の一部です)の形態が乱れることがわかりました(Takano et al., 2010; 2011;下図)。Sbno1ノッ クアウトマウスを作成すると、驚くべきことに大脳皮質がない仔マウスが生まれてきました。Sbno1タ ンパク質は幹細胞の制 御に何らかの役割を持っていることが期待されます。現在はSbno1タ ンパク質の生化学的性質を明らかにするために細胞培養などのvitroの 実験を進めているところです。
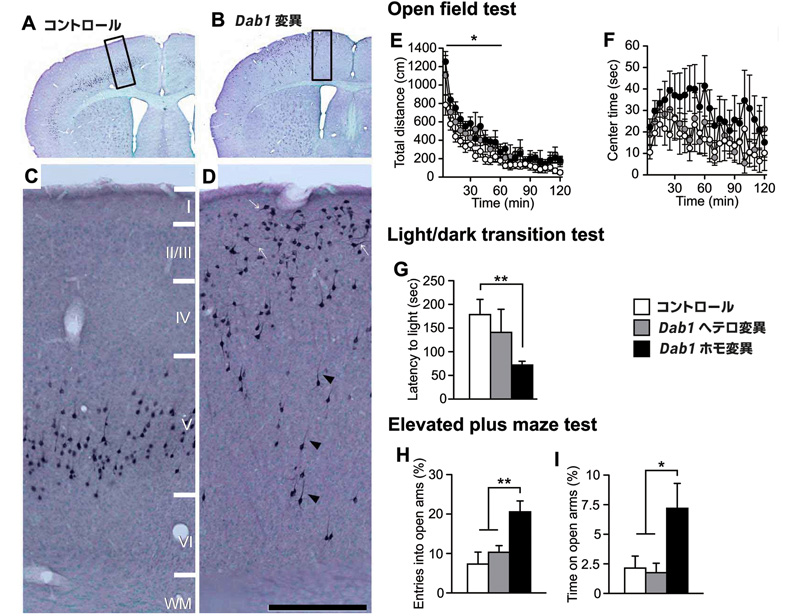
(3)Reelin-Dab1シグナルは
大脳皮質層構造を形成するのに必須な分子機構です。Reelin変
異reelerマウスで
は正常な大脳皮質に見られる層構造が大きく乱れています(下図;Dekimoto et al., 2010)。Reelin-Dab1シグナルは小脳など脳の他の部位の形態形成にも重要な働き
をしています。一方で、Reelin-Dab1シグナルがヒトの精神疾患と関連してい
るという多くの報告があります。我々は大脳皮質で
特異的にDab1を欠損する遺伝子改変マウスを作成し、網羅的に
行動実験を行いました。その結果、実際にReelin-Dab1シ
グナルが欠損すると精神疾患に関連しているとされる行動異常を、この遺伝子改変マウスで観察することができました(Imai et al., 2016)。今後は、このマウスのより詳細
な行動異常の解析や、症状とストレスや加齢との関係、薬理学的処理の影響を調べることで、このシグナル経路の精神疾患に
おける役割を明らかにし(Nishibe et al., 2018;
2022)、治療や診断法の開発などにつなげていきたいと考えています。

勝山裕 ラボホームページ
(4)ニュー
ロンのロバストネス
脳は
1キロ強の臓器であり平均的な人の体重の50分の1程度ですが、全身が消費する酸素やグルコースの4分の1くらいを消費しま
す。脳の機能を担うニューロン1つが1秒に消費するATPは50億個くらいとも言われています。つまりニューロンは例外的に
エネルギーを多く要求する細胞なのです。ATPを合成するために使われる酸素の1から3%が活性酸素種となりゲノムDNAに
とって有害になります。つまりニューロンのゲノムは極めて不安定であると言えます(Zolzaya et al.,
2024; 井原&勝山, 2024)。
健康な体は新陳代謝によって保たれます。消化管の粘膜上皮細胞は2、3日で、皮膚の細胞は1カ月くらい、血液なら3カ月く
らいで入れ替わります。しかし脳を構成するニューロンはそのような入れ替わりがほとんど起きません。我々の脳の
ニューロンは我々の年齢と同じ間、脳が働くために活動してきました。ニューロンは不安定なゲノムを持つにもかかわらず長い時
間を正常に働き続けなくてはいけません。興味深いことにウェルナー症など早老症では全身で様々な老化現象が見られますが、脳
機能の障害はほとんど起きません。これらの事実からもニューロンでは細胞の内外から生じるストレスに抗う特別な仕組みがある
ように思われます。
脳やそれを構成するニューロンの働きのような複雑な系ではロ
バストネスによって機能が保たれます。ニューロンのロバストネス破綻が脳の発生過程で起こると精神遅滞や自閉症
のような先天的な障害となり、成長段階で起こると統合失調症や重度の鬱な
どの精神疾患となり、老化とともに起こると認知症やALSのような神経変性症になるのではないでしょうか。我々はニューロンのロバストネスを担う分子機構
を明らかにしたいと考え研究を進めています。
研究に大きな影響を受けたJoseph Altman博士が2016年4月に亡くなりました。
Altman博士の追悼文