ヒト乳がん移植マウスにおいてmTOR阻害薬であるラパマイシンは抗がん剤による卵巣毒性の軽減と乳がんの増殖抑制を両立する
論文タイトル
Rapamycin prevents cyclophosphamide-induced ovarian follicular loss and potentially inhibits tumour proliferation in a breast cancer xenograft mouse model
掲載誌
Human Reproduction
執筆者
Yuji Tanaka, Tsukuru Amano, Akiko Nakamura, Fumi Yoshino, Akie Takebayashi, Akimasa Takahashi, Hiroyuki Yamanaka, Ayako Inatomi, Tetsuro Hanada, Yutaka Yoneoka, Shunichiro Tsuji, Takashi Murakami
(太字は本学の関係者)
論文概要
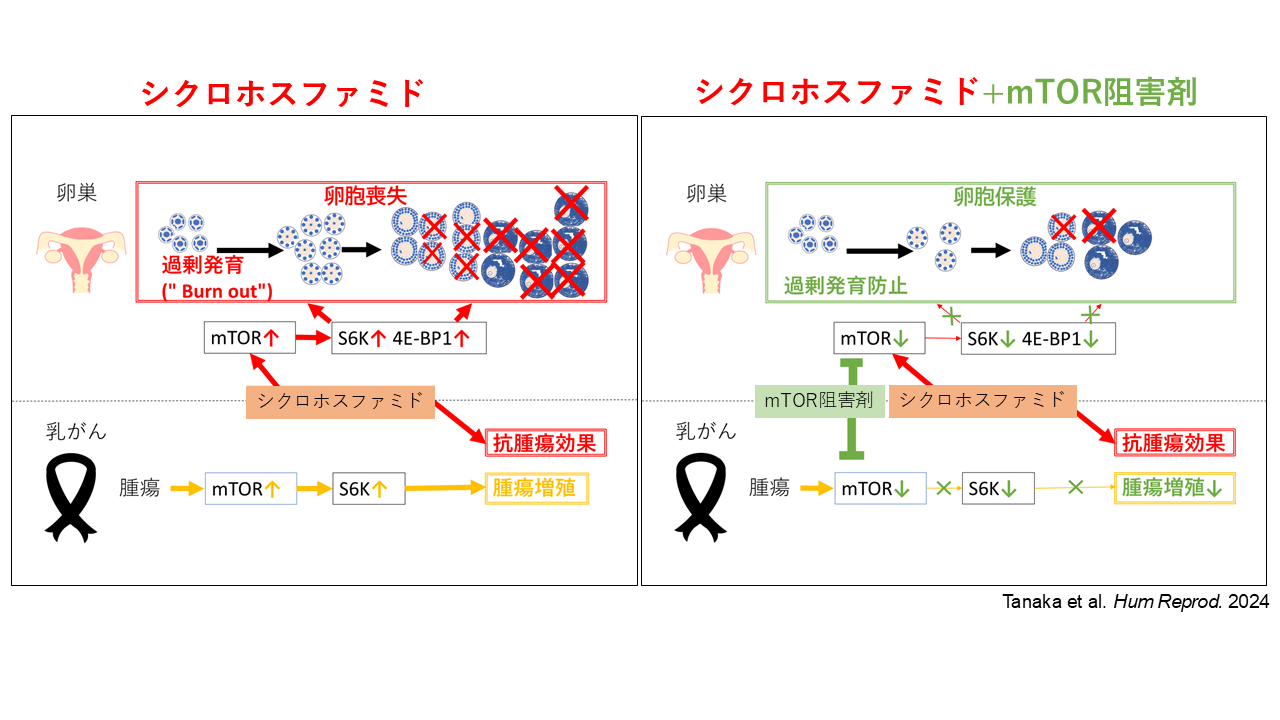
乳がんは思春期・若年成人女性に最も多いがんであり、術後には卵巣に影響を与えやすいシクロホスファミドなどの抗がん剤が使用されます。そのため、治療を受ける方は妊孕性(将来妊娠できる可能性)の低下と再発という二つの不安を抱えることになります。私たちは、抗腫瘍効果を持つ卵巣保護薬を用い、卵巣への影響を抑えつつ治療効果を高める方法を考案しました。従来の研究ではホルモン剤の有効性は限定的であり、非ホルモン作用型の戦略が望まれます。私たちはこれまで、抗がん剤による卵巣の障害はmTOR (mammalian target of rapamycin)経路の活性化で起こること、再発乳がん治療薬でもあるmTOR阻害薬が卵巣や子宮内膜への毒性を軽減することを明らかにしてきました。しかし、卵巣保護と腫瘍抑制を同時に評価した報告はありません。本研究では、乳がん移植マウスに高用量シクロホスファミドとmTOR阻害薬を併用したところ、卵胞発育の過剰活性化が抑えられ、原始卵胞の消耗が軽減されるとともに、腫瘍の細胞増殖も抑制されることがわかりました。本研究は、乳がん治療において妊孕性温存と腫瘍抑制を両立させる可能性を示す初めての研究であり、今後の臨床応用につながることが期待されます。

1: Tanaka et al. Exp Anim. 2018
2. Nakamura, Tanaka et al. Sci Rep. 2025
3: Tanaka et al. Clin Exp Reprod Med. 2025
4: Tanaka et al. Ann Hematol. 2024
5: Nakamura, Tanaka et al. Mol Hum Reprod. 2024
6: Tanaka er al. F&S Rev. 2025
文責
産科学婦人科学講座(女性) 田中 佑治
