- 2025.09.11 ヒト乳がん移植マウスにおいてmTOR阻害薬であるラパマイシンは抗がん剤による卵巣毒性の軽減と乳がんの増殖抑制を両立する
- 2025.08.06 神経発達障害関連因子によるニューロンのゲノムを保護する新規分子機構
- 2024.05.20 ストレスによる報酬系の異常は特徴的な摂食行動パターンを呈する
- 2024.01.26 薬物代謝酵素CYP2C19の遺伝子型と胃酸分泌抑制薬ランソプラゾール投与による腎機能障害との関係
- 2024.01.26 舌下免疫療法はスギ花粉症患者の抗原特異的IgEの活性を低下させる
- 2023.03.29 RhoAはパーキンによるミトコンドリア品質維持機能を介して心臓老化を阻止する
- 2022.10.26 血管平滑筋のRhoAはMAP4K4の活性を制御して腹部大動脈瘤の発生を抑制する
- 2022.09.08 大脳皮質地図の可塑性にはReelin遺伝子が関与する
- 2022.07.27 胃食道接合部の解剖、病態生理および臨床的意義に関する京都国際コンセンサス報告書
- 2022.04.20 タウによる二本鎖DNA損傷修復不全はin vitroでアルツハイマー病理を呈する
- 2022.03.29 脂肪細胞のナルディライジンはUCP1の発現と体温恒常性を調節する
- 2022.03.16 アミロイドβ産生を抑制するFAM3Cはアルツハイマー病患者の脳において転写が阻害されることにより発現が減少する
- 2022.02.25 カニクイザルの腫瘍拒絶モデルにおいて腫瘍に浸潤したT細胞や末梢血中のT細胞から腫瘍殺傷能力をもつT細胞受容体遺伝子の単離
- 2021.06.07 ジペプチジルペプチダーゼIIIは糖尿病マウスにおいて心・腎保護作用を発揮する
- 2021.05.07 ストマチンはAktシグナルを抑制してがんの増大を阻止する
- 2021.03.12 2D培養、3D培養、異種移植片における舌がん細胞代謝物の類似点と相違点
- 2021.02.25 ケト型のクルクミン誘導体はAβオリゴマーに結合するがフィブリルには結合しない
- 2021.01.20 カニクイザルにおけるSARS-CoV-2に対する中和抗体依存性と非依存性免疫反応
- 2020.08.18 ケトン体が糖尿病性腎臓病における腎組織修復の鍵となる −糖尿病性腎臓病克服への可能性に期待−
- 2020.07.27 ナルディライジンはp75NTRの細胞外ドメイン切断を介して心臓交感神経の分布様式を制御する
- 2020.05.26 吸入麻酔薬の膜電位依存性カリウムチャネルにおける作用部位の特定
- 2020.05.15 ―あたらしい心電図の指標-QT延長症候群8型においてLate appearance T waveは予後予測に有用である
- 2020.05.11 アミロイドβ前駆体タンパク質を発現するアルツハイマー病モデルカニクイザルの作出に成功
- 2020.04.07 家族性ブルガダ症候群でtransmembrane protein 168遺伝子の新規変異を同定
- 2019.12.19 PKD1に変異を持つサルは人の常染色体優勢多発性嚢胞腎を再現する
- 2019.04.08 モデル動物が群れをつくるメカニズムを解明
- 2019.04.03 ベラパミルはヒトKv1.5チャネルのポア領域に結合してチャネルをブロックする
- 2019.04.01 日本人患者における先天性QT延長症候群の遺伝的および臨床的側面と生命を脅かす不整脈との関連
- 2010 - 2018年度分
ヒト乳がん移植マウスにおいてmTOR阻害薬であるラパマイシンは抗がん剤による卵巣毒性の軽減と乳がんの増殖抑制を両立する
論文タイトル
Rapamycin prevents cyclophosphamide-induced ovarian follicular loss and potentially inhibits tumour proliferation in a breast cancer xenograft mouse model
掲載誌
Human Reproduction
執筆者
Yuji Tanaka, Tsukuru Amano, Akiko Nakamura, Fumi Yoshino, Akie Takebayashi, Akimasa Takahashi, Hiroyuki Yamanaka, Ayako Inatomi, Tetsuro Hanada, Yutaka Yoneoka, Shunichiro Tsuji, Takashi Murakami
(太字は本学の関係者)
論文概要
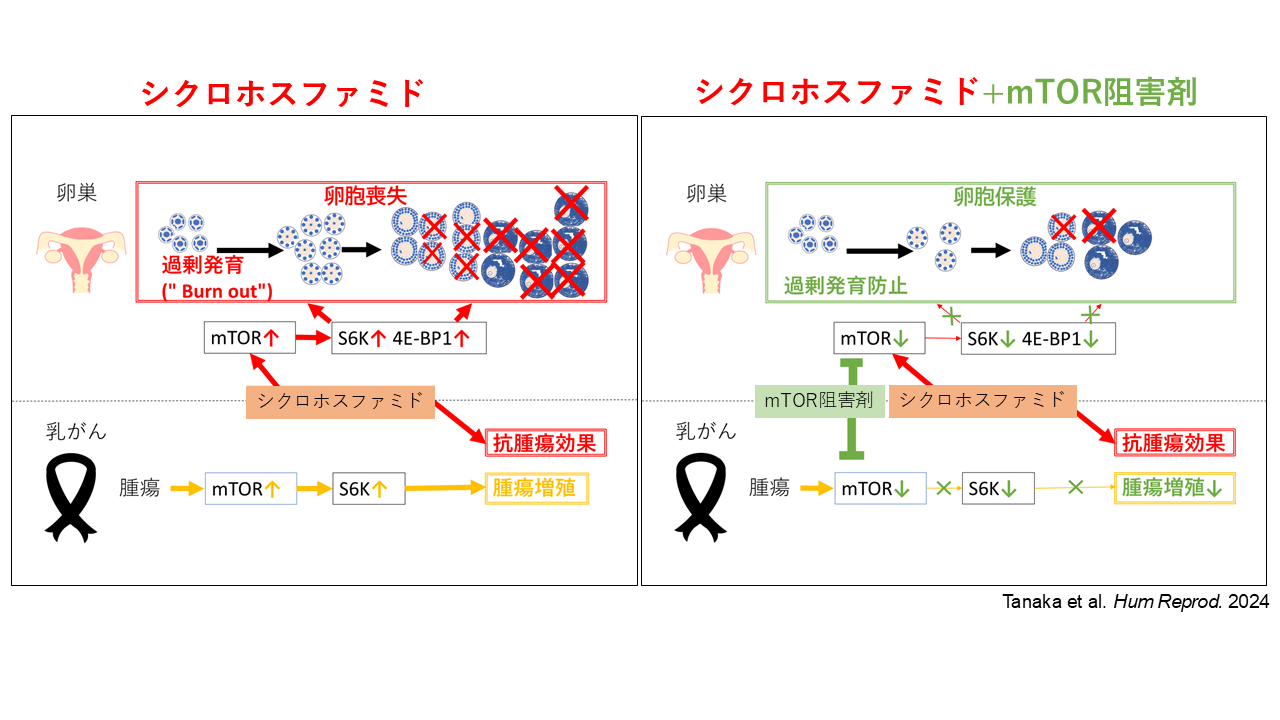
乳がんは思春期・若年成人女性に最も多いがんであり、術後には卵巣に影響を与えやすいシクロホスファミドなどの抗がん剤が使用されます。そのため、治療を受ける方は妊孕性(将来妊娠できる可能性)の低下と再発という二つの不安を抱えることになります。私たちは、抗腫瘍効果を持つ卵巣保護薬を用い、卵巣への影響を抑えつつ治療効果を高める方法を考案しました。従来の研究ではホルモン剤の有効性は限定的であり、非ホルモン作用型の戦略が望まれます。私たちはこれまで、抗がん剤による卵巣の障害はmTOR (mammalian target of rapamycin)経路の活性化で起こること、再発乳がん治療薬でもあるmTOR阻害薬が卵巣や子宮内膜への毒性を軽減することを明らかにしてきました。しかし、卵巣保護と腫瘍抑制を同時に評価した報告はありません。本研究では、乳がん移植マウスに高用量シクロホスファミドとmTOR阻害薬を併用したところ、卵胞発育の過剰活性化が抑えられ、原始卵胞の消耗が軽減されるとともに、腫瘍の細胞増殖も抑制されることがわかりました。本研究は、乳がん治療において妊孕性温存と腫瘍抑制を両立させる可能性を示す初めての研究であり、今後の臨床応用につながることが期待されます。

1: Tanaka et al. Exp Anim. 2018
2. Nakamura, Tanaka et al. Sci Rep. 2025
3: Tanaka et al. Clin Exp Reprod Med. 2025
4: Tanaka et al. Ann Hematol. 2024
5: Nakamura, Tanaka et al. Mol Hum Reprod. 2024
6: Tanaka er al. F&S Rev. 2025
文責
産科学婦人科学講座(女性) 田中 佑治
神経発達障害関連因子によるニューロンのゲノムを保護する新規分子機構
論文タイトル
Strawberry notch 1 safeguards neuronal genome via regulation of Yeats4 expression
掲載誌
Cell Death Discovery
執筆者
Dai Ihara, Ayano Narumoto, Yukie Kande, Tomoki Hayashi, Yasuaki Ikuno, Manabu Shirai, Masaki Wakabayashi, Ryo Nitta, Hayato Naka-Kaneda & Yu Katsuyama
(太字は本学の関係者)
論文概要
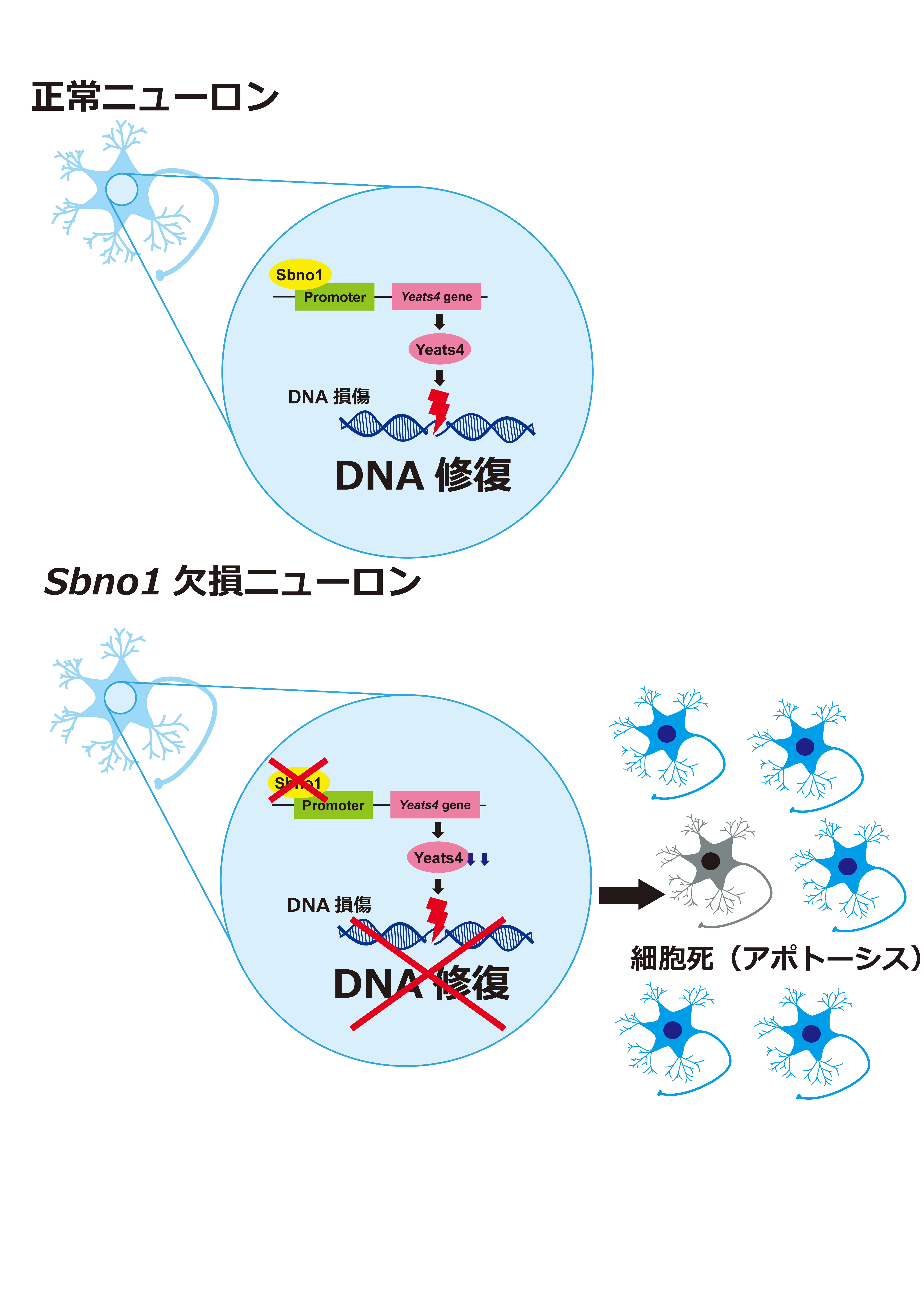
私たちの脳を構成している神経細胞(ニューロン)は、出生時から生涯にわたり脳の機能を担います。一方でニューロンは酸素要求が高く、遺伝子発現の変化も活発であるため、これらのストレスによってDNAが損傷を受けやすいという性質を持ちます。しかし、長寿であるニューロンがDNAを保護する分子レベルの仕組みは解明されていませんでした。 本研究では、自閉症や統合失調症の患者で遺伝子変異が報告されているSBNO1の機能に着目しました。Sbno1を欠損させたマウスの大脳皮質では、DNAの二本鎖切断が顕著に増加し、その結果として多くのニューロンが細胞死を起こすことがわかりました。 網羅的遺伝子発現解析(RNA-seq)により、Sbno1欠損大脳皮質では、Yeats4という別の遺伝子の発現が低下していることが判明しました。Yeats4の機能を阻害すると、Sbno1欠損と同様にDNA損傷が誘導され、逆にSbno1欠損ニューロンにYeats4を過剰発現させると、DNA損傷は抑制されました。 これらの結果から、Sbno1がYeats4を介してニューロンのDNAを保護するという新たな分子機構が示されました。この発見は、神経細胞におけるDNA保護のメカニズムを明らかにしただけでなく、SBNO1が関わる神経発達障害発症の原因の理解にもつながる可能性があります。本研究は登録研究医コースの学生3名が参加し共著者となっています。
文責
解剖学講座(神経形態学部門) 勝山 裕
ストレスによる報酬系の異常は特徴的な摂食行動パターンを呈する
論文タイトル
Stress-impaired reward pathway promotes distinct feeding behavior patterns
掲載誌
Frontiers in Neuroscience
執筆者
Yusuke Fujioka, Kaori Kawai, Kuniyuki Endo, Minaka Ishibashi, Nobuyuki Iwade, Dilina Tuerde, Kozo Kaibuchi, Takayuki Yamashita, Akihiro Yamanaka, Masahisa Katsuno, Hirohisa Watanabe, Gen Sobue, Shinsuke Ishigaki
(太字は本学の関係者)
論文概要
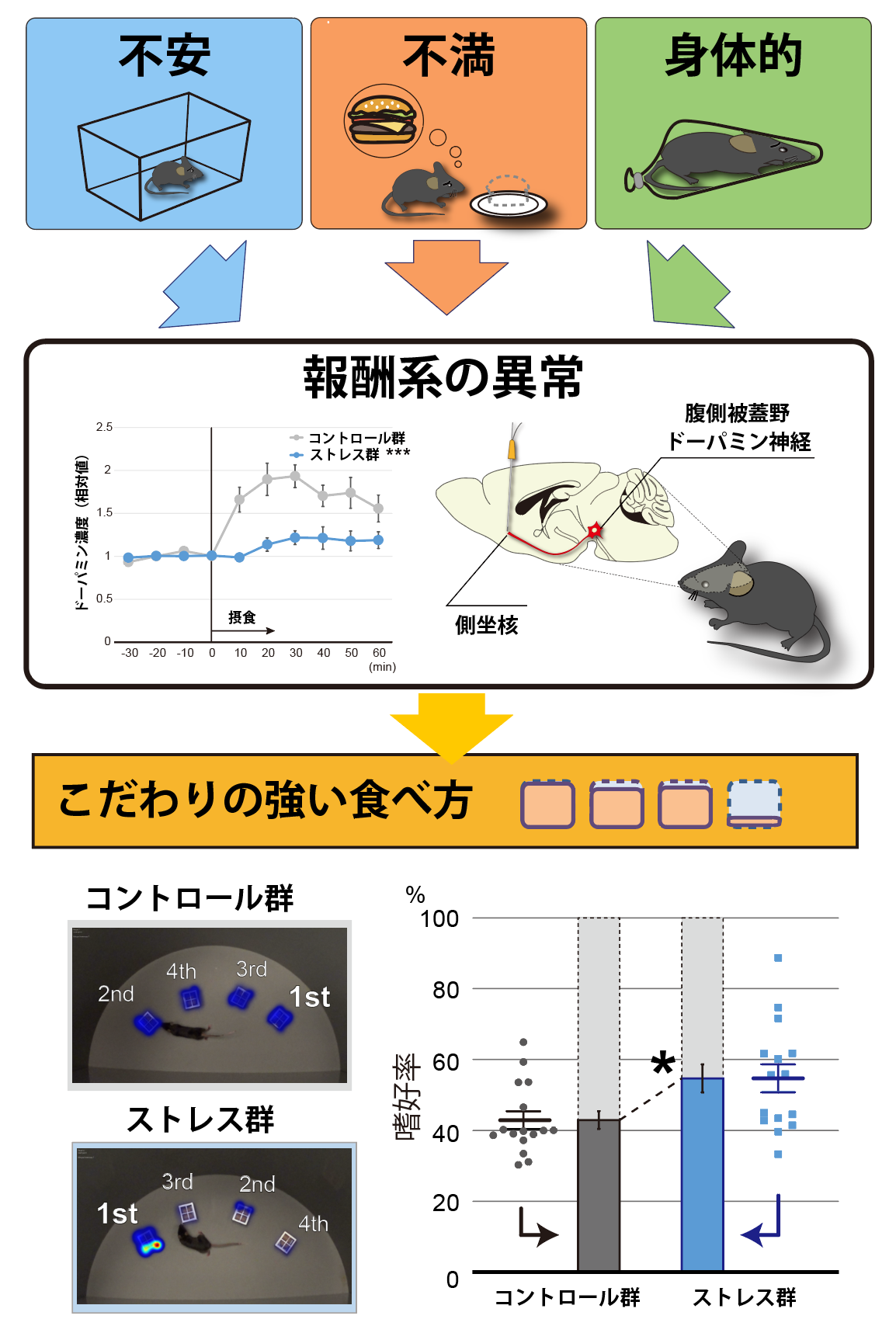
摂食行動は精神神経疾患で変化することが知られていますが、ストレスなどの環境要因によっても変化します。私たちは、社会的隔離(不安)、間欠的な高脂肪食(不満)、身体的拘束(身体的ストレス)といった複数のストレスマウスモデルにおいて、摂食行動や一般的な身体所見を観察しましたが、摂食量や体重等に共通の変化を見出すことはできませんでした。一方で、新たに我々が考案した定量方法を用いて「食べ方」に着目したところ、全てのストレスマウスモデルに共通してこだわりが強くなったかのような偏った食べ方(全ての餌場には同じ餌が入っているにもかかわらず特定の餌場に固執する)が生じることが分かりました。また、ストレスを受けたマウスでは摂食時の側坐核におけるドーパミン濃度の上昇の程度が低いこと、側坐核にドーパミンを補うと食べ方の偏りが正常化することも明らかになりました。さらに、マウスの側坐核に投射するドーパミン神経細胞の興奮性を遺伝薬理学的に抑制しストレスと同じ状況を再現すると、ストレスがある時と同様の偏った食べ方をすることが判明しました。これらの結果から、「食べ方」の変化は、中脳辺縁系のドーパミン系を中心とした報酬系の異常を直接反映している可能性が高いと考えられ、ストレスの存在を客観的に評価するバイオマーカーとして利用できることが期待されます。
文責
神経難病研究センター橋渡し研究ユニット神経診断治療学部門 藤岡 祐介
薬物代謝酵素CYP2C19の遺伝子型と胃酸分泌抑制薬ランソプラゾール投与による腎機能障害との関係
論文タイトル
Relationships of proton pump inhibitor-induced renal injury with CYP2C19 polymorphism: a retrospective cohort study
掲載誌
Clinical Pharmacology and Therapeutics
執筆者
Rika Fukui, Satoshi Noda, Yoshito Ikeda, Yuichi Sawayama, Tomohiro Terada, Yoshihisa Nakagawa, Shin-ya Morita
(太字は本学の関係者)
論文概要
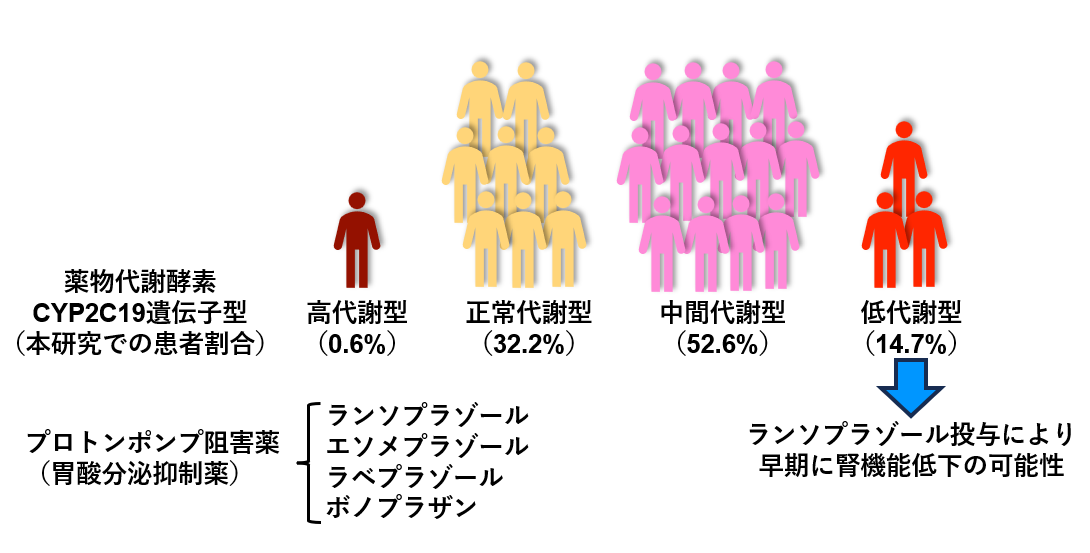
胃潰瘍治療などに使用するプロトンポンプ阻害薬(胃酸分泌抑制薬)のランソプラゾールやエソメプラゾール、ラベプラゾール、ボノプラザンの投与により、副作用として腎機能障害が生じることがあります。これらのプロトンポンプ阻害薬は、肝臓で酵素による代謝を受けてから体外へと排泄されるため、代謝酵素活性が低下している患者さんでは、薬物が体内に長く残ることで副作用が生じやすくなることが予想されます。プロトンポンプ阻害薬の代謝に関わる酵素であるCYP2C19の遺伝子型は、代謝活性に応じて高代謝型・正常代謝型・中間代謝型・低代謝型に分類されます。本研究では、患者さんをCYP2C19低代謝型群と非低代謝型群(高代謝型・正常代謝型・中間代謝型)の2群に分け、薬物代謝酵素の遺伝子型とプロトンポンプ阻害薬による腎機能障害の関係を後方視的に過去に遡って調べました。解析を行った結果、ランソプラゾールを投与された患者さんにおいて、CYP2C19低代謝型群は非低代謝型群と比べて、早期に腎機能低下が生じていたことが示されました。一方で、エソメプラゾールあるいはラベプラゾール、ボノプラザンを投与された患者さんでは、CYP2C19低代謝型群と非低代謝型群との間で腎機能低下の時期に差は見られませんでした。これらの結果から、患者さんのCYP2C19 の遺伝子型を検査することが、ランソプラゾール投与による腎機能障害の回避に役立つことが期待されます。
文責
薬物治療学講座 森田 真也
舌下免疫療法はスギ花粉症患者の抗原特異的IgEの活性を低下させる
論文タイトル
Sublingual immunotherapy decreases the avidity of antigen-specific IgE in patients with Japanese cedar pollinosis
掲載誌
Allergy
執筆者
Nakamura K, Kouzaki H, Murao T, Kawakita K, Arai H, Matsumoto K, Kubo Y, Tojima I, Shimizu S, Ogawa Y, Yuta A, Sakai R, Ohno H, Kido H, Shimizu T.
(太字は本学の関係者)
論文概要
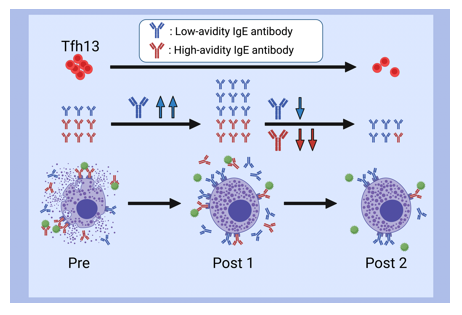
スギ花粉症は本邦において約4000万人が罹患しています。舌下免疫療法(SLIT)は、スギ花粉症を根治に近い状態にできる治療法です。SLITにより血清中の抗原特異的IgEは、1年後に一過性に上昇し、その後徐々に低下します(図1)。何故、抗原特異的IgEが上昇するのかについて着目しました。 抗原特異的IgE抗体は、抗原親和性の違いから高親和性の抗体と低親和性の抗体があります(図2)。SLIT前後の血清中のスギ花粉アレルゲンコンポーネントであるCry j 1およびCry j 2特異的IgEについて、親和性の指標であるIC50値を調べると、スギ花粉症患者ではSLIT前のCry j 1およびCry j 2特異的IgEのIC50値は低く(高親和性IgE)、SLIT開始後1―3年を通して一貫して上昇することがわかりました。これはSLITにより高親和性IgEから低親和性IgEに移行したことを示しています(図3AおよびB)。さらに、高親和性IgEにクラススイッチしたB細胞を誘導するTfh13細胞の頻度がSLIT開始後2年で有意に減少することを見出しました(図4AおよびB)。この結果は、SLITによってTfh13細胞が減少するため高親和性IgEの産生が抑制されることを示しています。 これらのことから、「舌下免疫療法によって誘導される抗原特異的な低親和性 IgE の産生」が治療効果に寄与していることを証明しました(図5)。
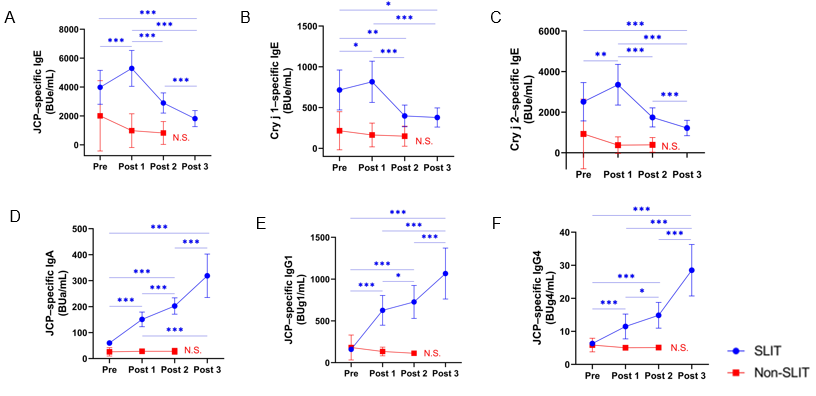
(A-C)スギ花粉症患者では舌下免疫療法後1年で、スギ花粉(JCP)特異的、Cry j 1特異的、Cry j2特異的IgEが増加する。
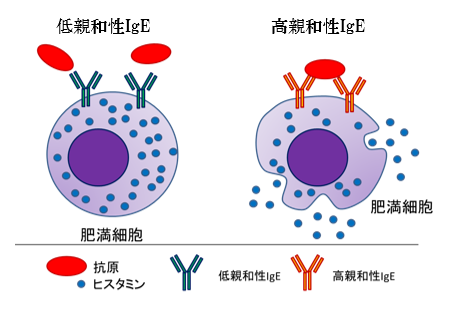
低親和性IgEでは抗原との架橋反応が起こらず、肥満細胞が脱顆粒しない
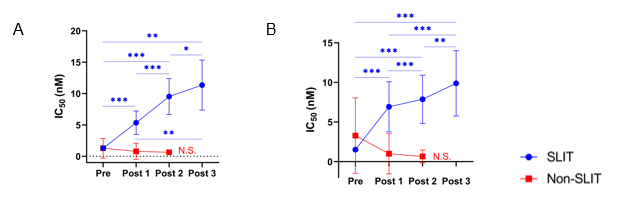
Cry j 1およびCry j 2に対する抗原特異的IgE抗体は治療前と比較し治療後1年では一旦上昇し、その後は減少した。
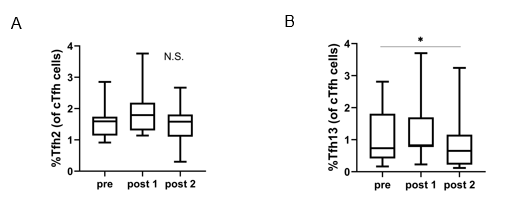
Tfh2は治療前後で有意な変化を認めなかったが、Tfh13は治療前と比較し治療後2年で減少した。
文責
耳鼻咽喉科・頭頸部外科 神前 英明
RhoAはパーキンによるミトコンドリア品質維持機能を介して心臓老化を阻止する
論文タイトル
RhoA rescues cardiac senescence by regulating Parkin-mediated mitophagy
掲載誌
Journal of Biological Chemistry. 2023; 299: 102993.
執筆者
Joanne Ern Chi Soh, Akio Shimizu, Md Rasel Molla, Dimitar P. Zankov, Le Kim Chi Nguyen, Mahbubur Rahman Khan, Wondwossen Wale Tesega, Si Chen, Misa Tojo,Yoshito Ito, Akira Sato, Masahito Hitosugi, Shigeru Miyagawa, Hisakazu Ogita
(太字は本学の関係者)
論文概要
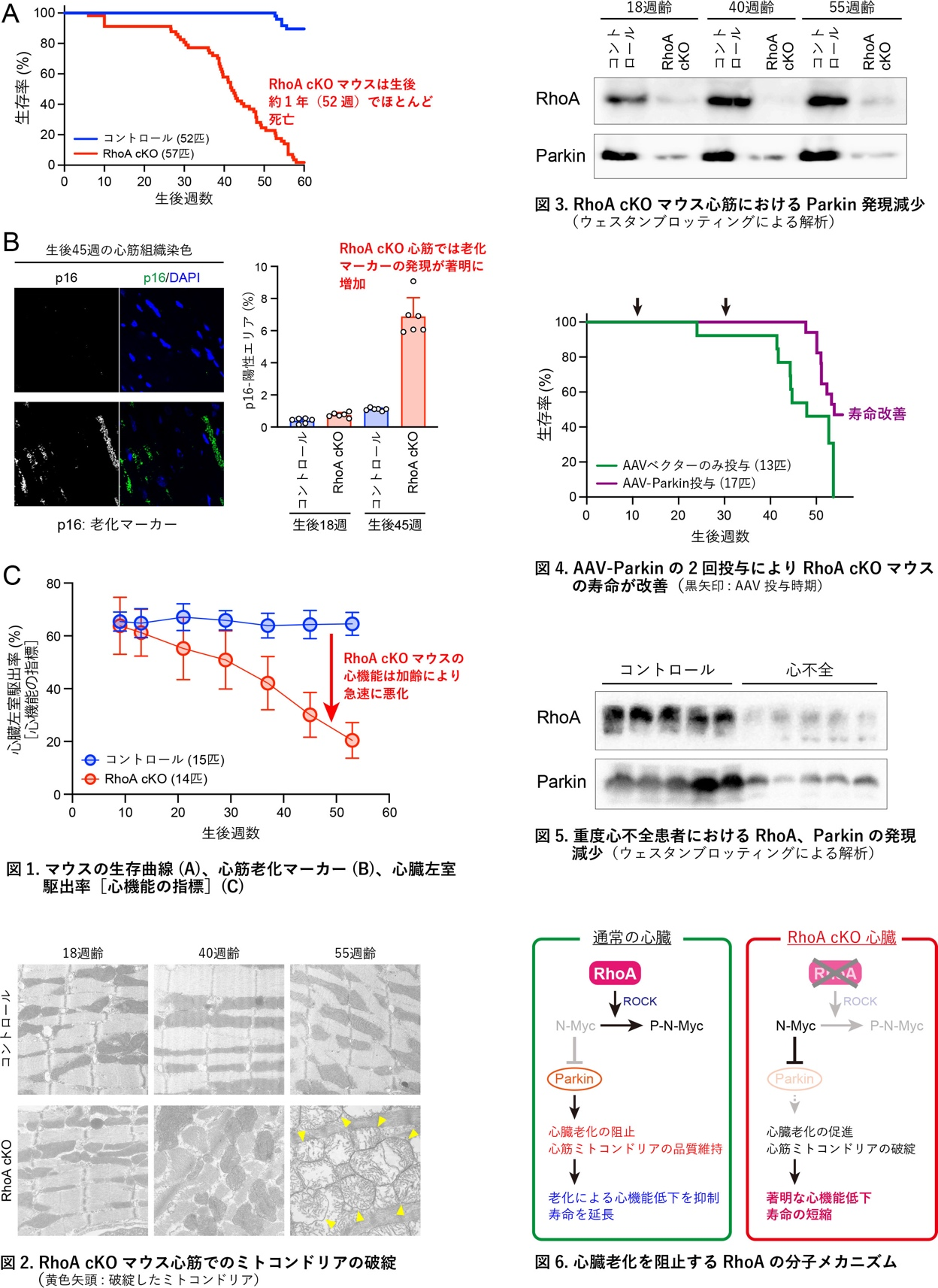
RhoAは細胞内のアクチン線維の走行を制御する分子として知られていますが、心臓におけるRhoAの必要性や役割についてはほとんど分かっていませんでした。そこで本研究では心筋細胞でRhoAの発現を欠失させたRhoAコンディショナルノックアウト(RhoA cKO)マウスを作製して解析しました。その結果、RhoA cKOマウスはコントロールマウスと比較して寿命が短くなり、その原因として心筋細胞の老化が急速に進み、心機能が著しく低下している(心不全になっている)ことを見出しました(図1)。心筋を電子顕微鏡で詳細に調べると、RhoA cKOマウス心筋内のミトコンドリアが加齢と共にほとんど破綻している状態でした(図2)。分子レベルでは、ミトコンドリアの品質維持(マイトファジー)において重要な働きをするパーキン(Parkin)の発現がRhoA cKOマウス心筋細胞で低下していました(図3)。そこでRhoA cKOマウスに、アデノ随伴ウイルスベクター(AAV)を利用して、AAV–Parkinを2回静脈内投与し、心臓でのParkin発現量を人工的に増やすと、心筋細胞の老化は阻止され、ミトコンドリアの破綻が抑制されたと共に心機能低下も抑制することができました。その結果、RhoA cKOマウスの寿命が改善しました(図4)。さらに、大人の重度心不全患者の心筋でもRhoAおよびParkinの発現が低下していることを初めて突き止めました(図5)。以上より、RhoAは心臓老化を防ぐ重要な分子であることとその分子メカニズムを明らかにしました(図6)。筆頭著者のSohさんは本研究成果が高く評価され、日本循環器学会国際留学生YIA最優秀賞を受賞しました。
文責
生化学・分子生物学講座(分子病態生化学部門) 扇田 久和
血管平滑筋のRhoAはMAP4K4の活性を制御して腹部大動脈瘤の発生を抑制する
論文タイトル
Vascular smooth muscle RhoA counteracts abdominal aortic aneurysm formation by modulating MAP4K4 activity
掲載誌
Communications Biology. 2022; 5: 1071.
執筆者
Md Rasel Molla, Akio Shimizu, Masahiro Komeno, Nor Idayu A. Rahman, Joanne Ern Chi Soh, Le Kim Chi Nguyen, Mahbubur Rahman Khan, Wondwossen Wale Tesega, Si Chen, Xiaoling Pang, Miki Tanaka-Okamoto, Noriyuki Takashima, Akira Sato, Tomoaki Suzuki, Hisakazu Ogita
(太字は本学の関係者)
論文概要
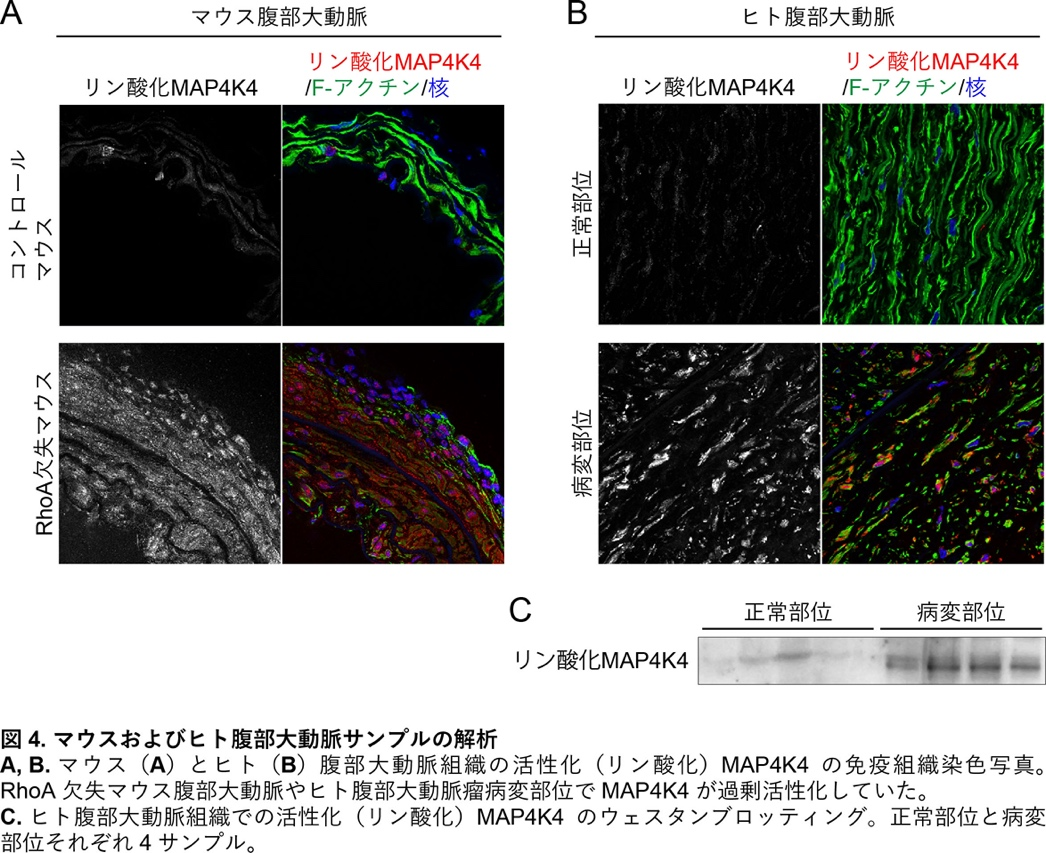
腹部大動脈瘤とはその名の通り、腹部を走行する大動脈が膨らんで瘤ができる病気ですが、いったん瘤が裂けてしまうと、救命は困難で非常に危険な病気です。一方、腹部大動脈瘤の発症メカニズムについては不明な点が多く残されています。
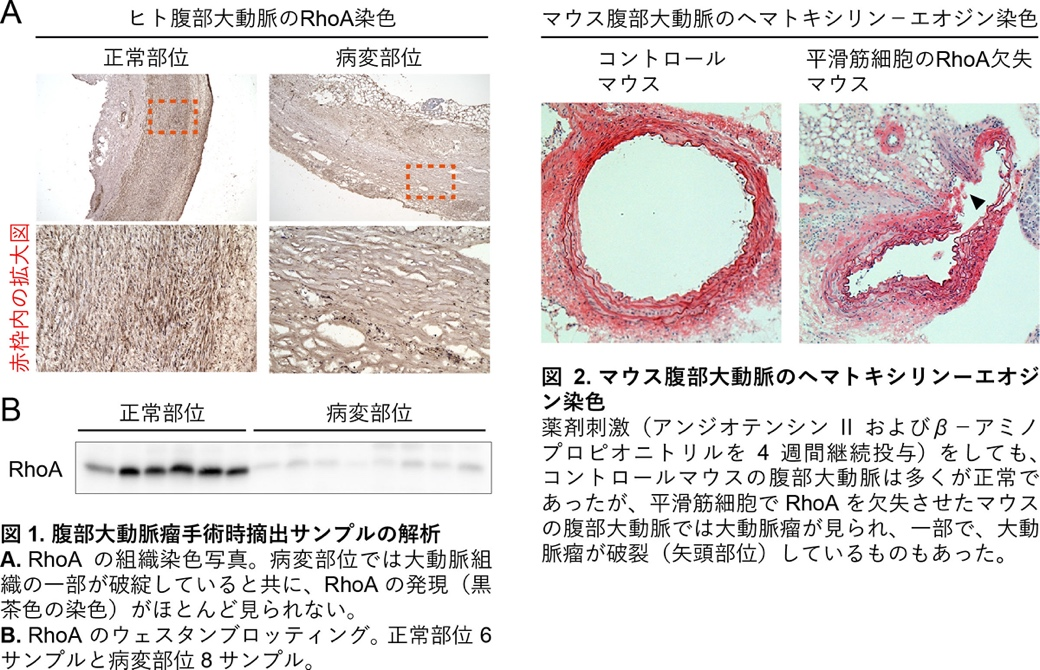
本研究では腹部大動脈瘤の手術をした患者さんのサンプルで、病変部位では健常部位と比べてRhoAの発現が低下していることを見出しました(図1)。このことが腹部大動脈瘤の発生に関係するかどうか調べるため、大動脈の主要な細胞である平滑筋細胞でRhoAの発現を欠失させた遺伝子改変マウスを作製しました。このマウスでは薬剤刺激により容易に腹部大動脈瘤が生じました(図2)。
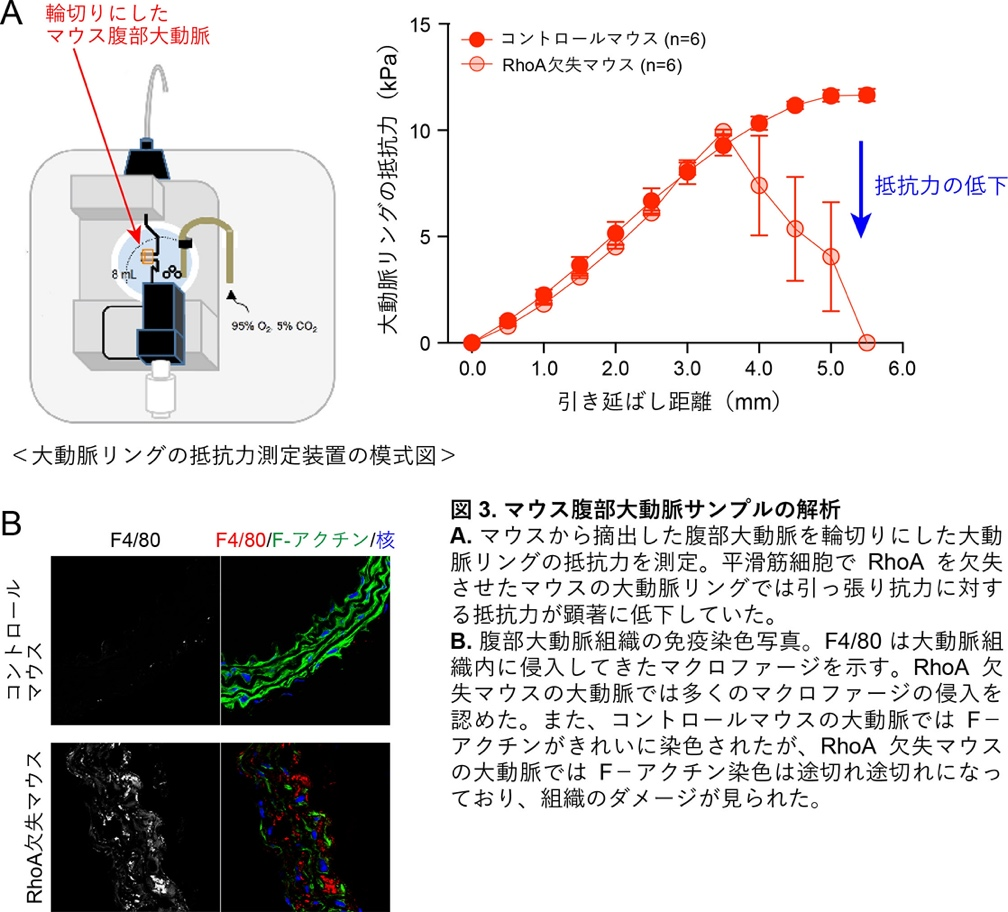
薬剤刺激後、マウス大動脈を摘出して実験を行いました。その結果、RhoAが欠失したマウスの大動脈は引っ張り抗力に対して弱くなっており、さらに、マクロファージなどの炎症細胞が大動脈壁内に多く入り込んでいました(図3)。これらの影響によりRhoA欠失マウスの大動脈は脆くなっていると考えられました。
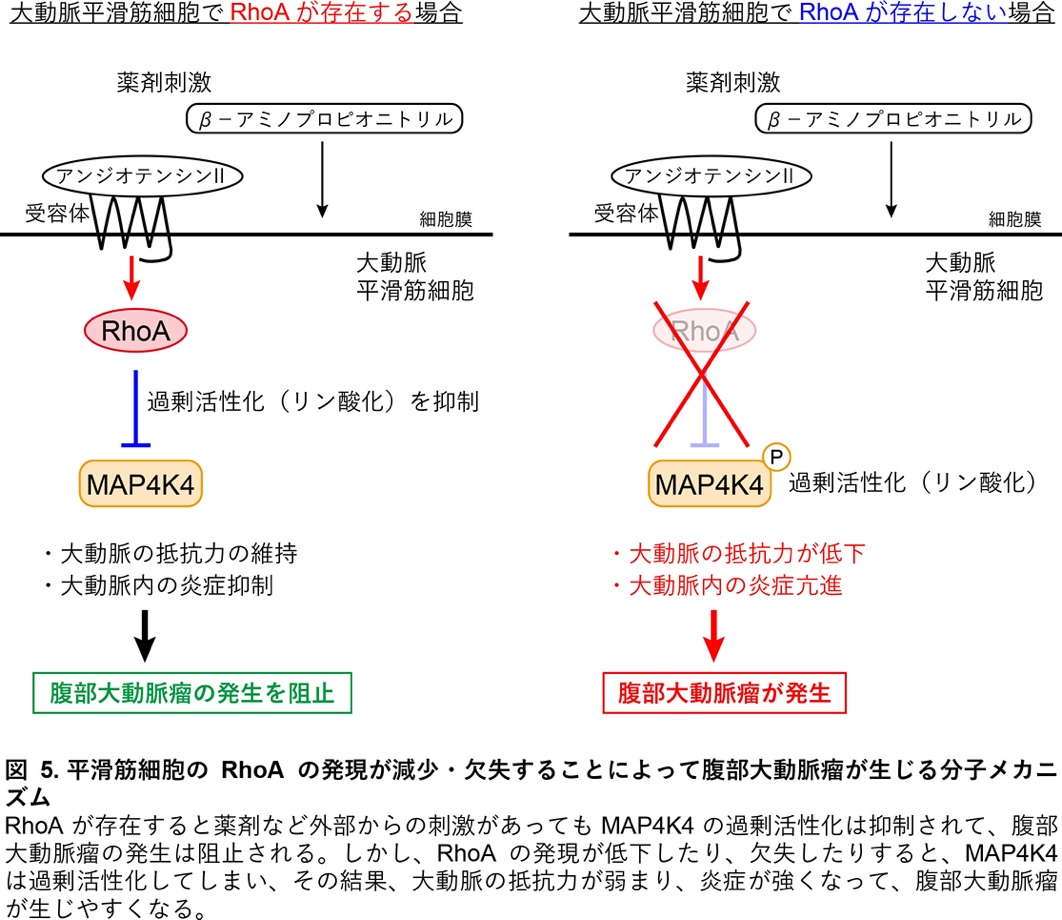
RhoA欠失マウスの大動脈を分子レベルで解析すると、組織の炎症などに関係する分子MAP4K4が過剰活性化(リン酸化)していることが分かりました(図4A)。このことは、腹部大動脈瘤の患者さんのサンプルでも認められました(図4B, C)。一方、MAP4K4の過剰活性化を抑制する化合物DMX-5804を投与すると、RhoA欠失マウスでも薬剤刺激による腹部大動脈瘤が生じにくくなりました。今回解明した腹部大動脈瘤発症の分子メカニズムの概略を図5に示します。
文責
生化学・分子生物学講座(分子病態生化学部門) 扇田 久和
大脳皮質地図の可塑性にはReelin遺伝子が関与する
論文タイトル
Synaptic and Genetic Bases of Impaired Motor Learning Associated with Modified Experience-Dependent Cortical Plasticity in Heterozygous Reeler Mutants
掲載誌
Cerebral Cortex (2022年度)
執筆者
Mariko Nishibe, Hiroki Toyoda, Shin-ichiro Hiraga, Toshihide Yamashita and Yu Katsuyama
(太字は本学の関係者)
論文概要
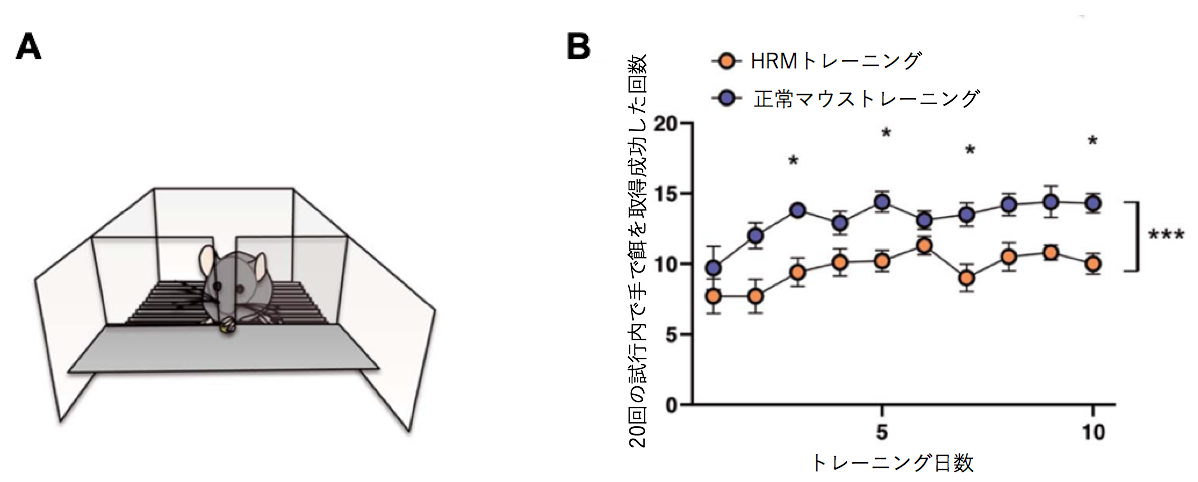
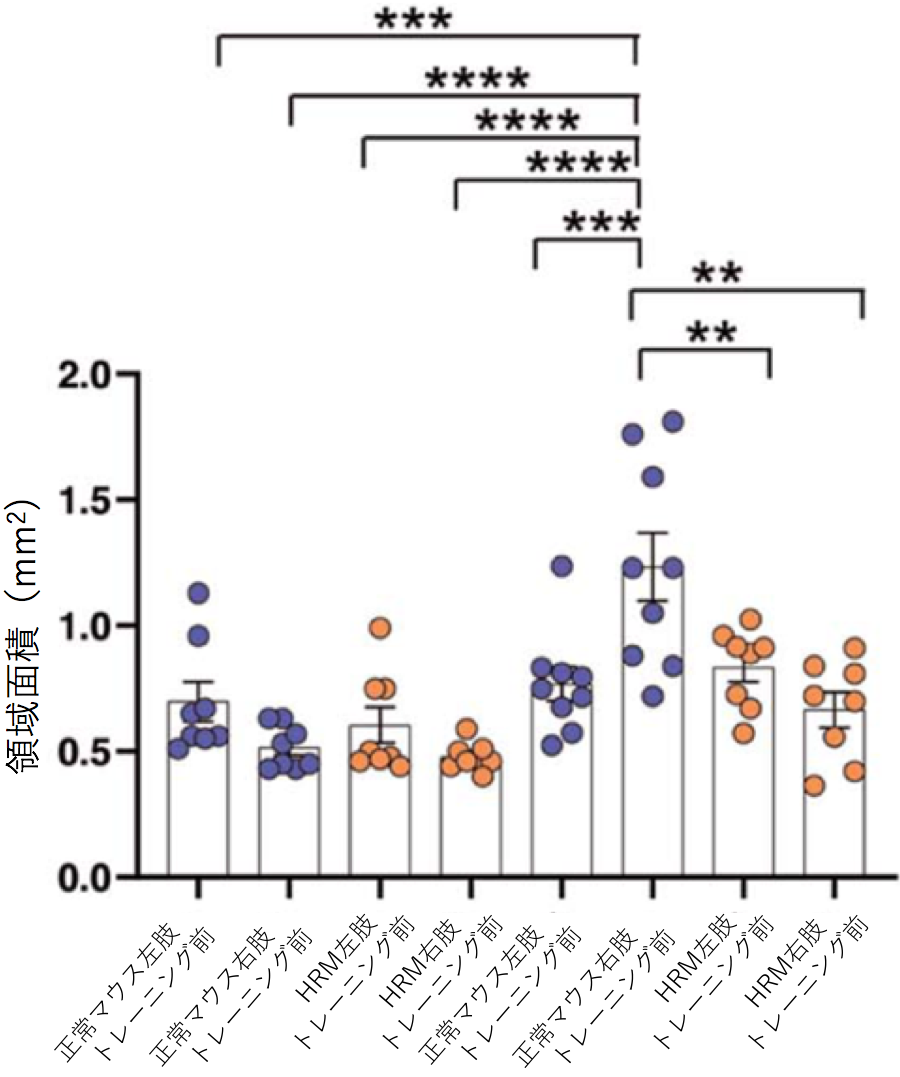
Reelinは統合失調症などの精神疾患との関連が指摘されている遺伝子です。一方で、精神疾患の患者では運動学習に障害があることが示されています。本研究ではReelin遺伝子の発現低下が運動学習にどのような影響を与えるかをマウスを用いて解析しました。 マウスは普段、口を使って餌を取りますが、運動学習によって、じょうずに(前足)で餌を取ることができるようになります。しかしReelin遺伝子の発現が半分になっているヘテロのReelin欠損マウス(HRM)では正常なマウスと比べて、運動学習の効果は見られませんでした(図1B)。 正常なマウスではトレーニングによって(利き手の反対側の)手の運動野の領域が大きくなるのに対してHRMではトレーニングを行っても手の運動を誘導する領域が広がりませんでした(図2)。またHRMではシナプスの長期増強が生じませんでした(図3)。またHRMではトレーニングの有無にかかわらず興奮性および抑制性シナプス後電流の頻度が両方とも常なマウスの大脳皮質ニューロンと比べて低下していることがわかりました(図4)。 さらにシナプスの機能やニューロンの可塑性に関わる遺伝子の発現をみると正常ではトレーニングにより上昇するのに対して、HRMではそのような発現増加は見られませんでした(図5、6)。 以上より本研究では精神疾患との関連が報告されているReelinが運動学習障害の原因にもなっている可能性を明らかにしました。
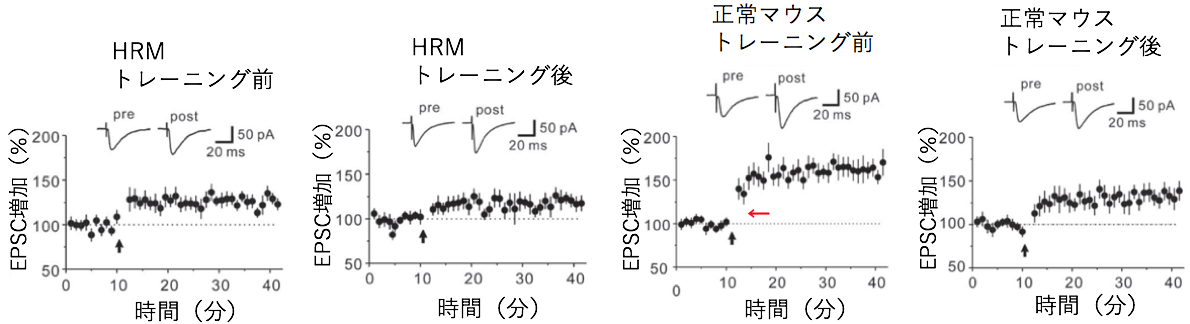
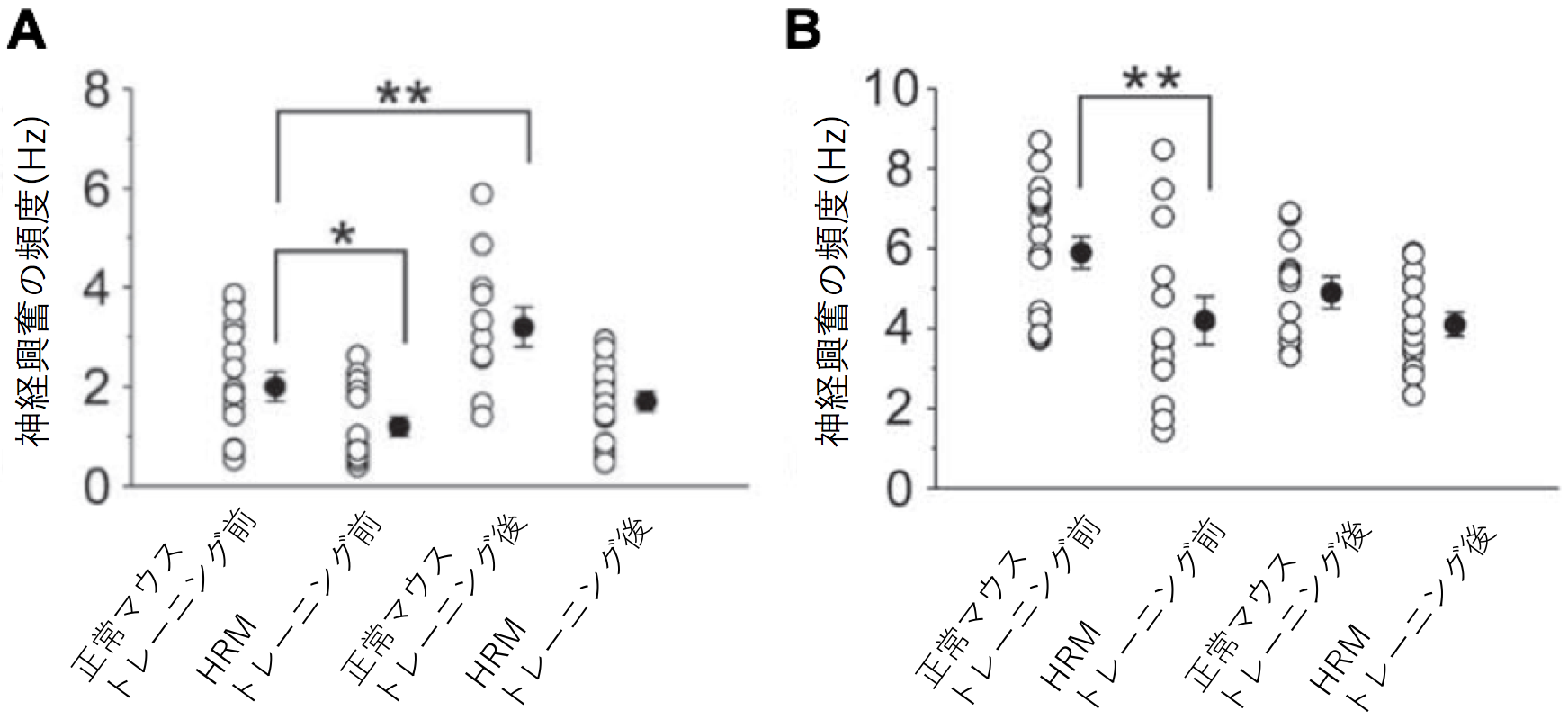
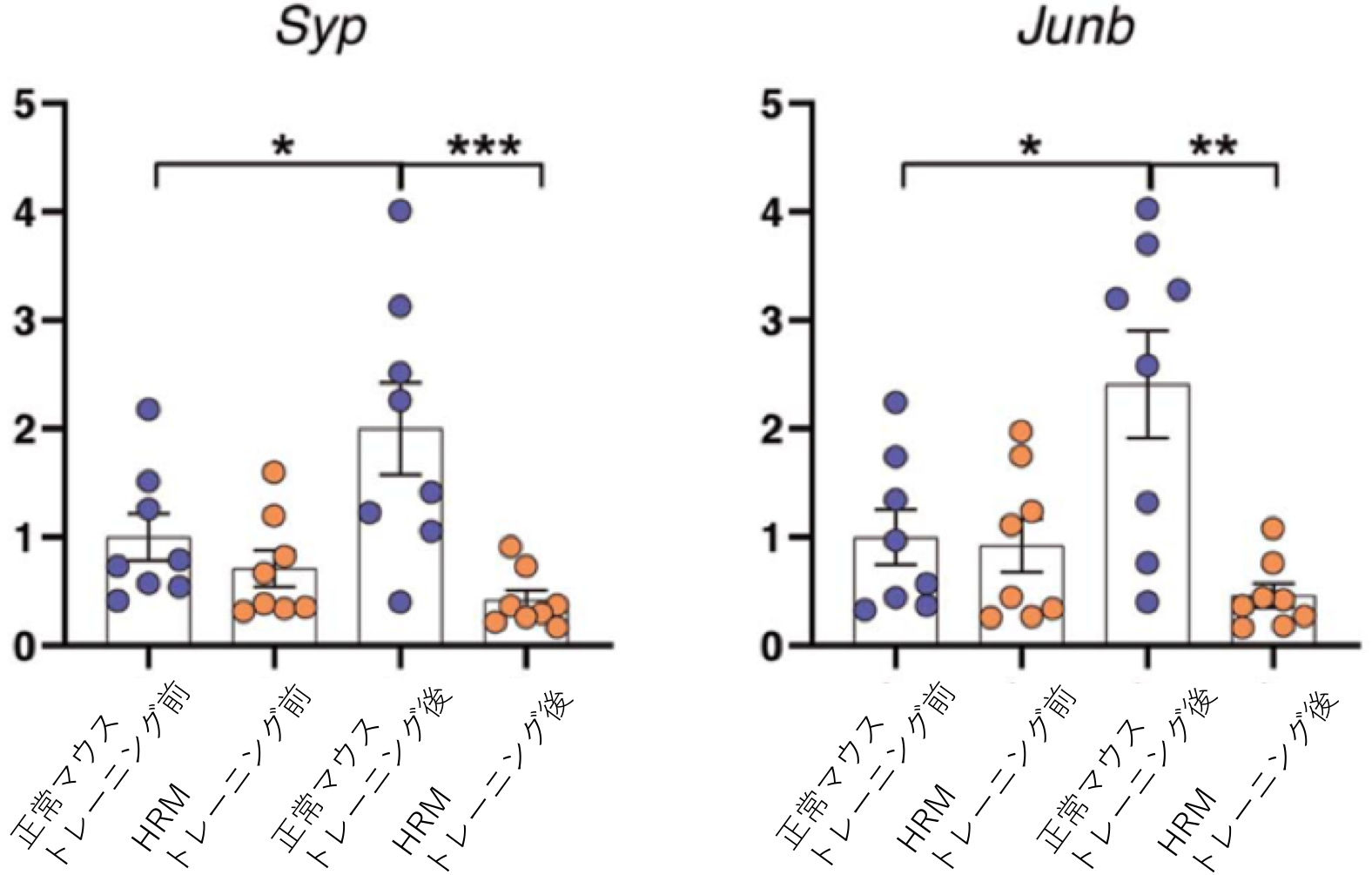
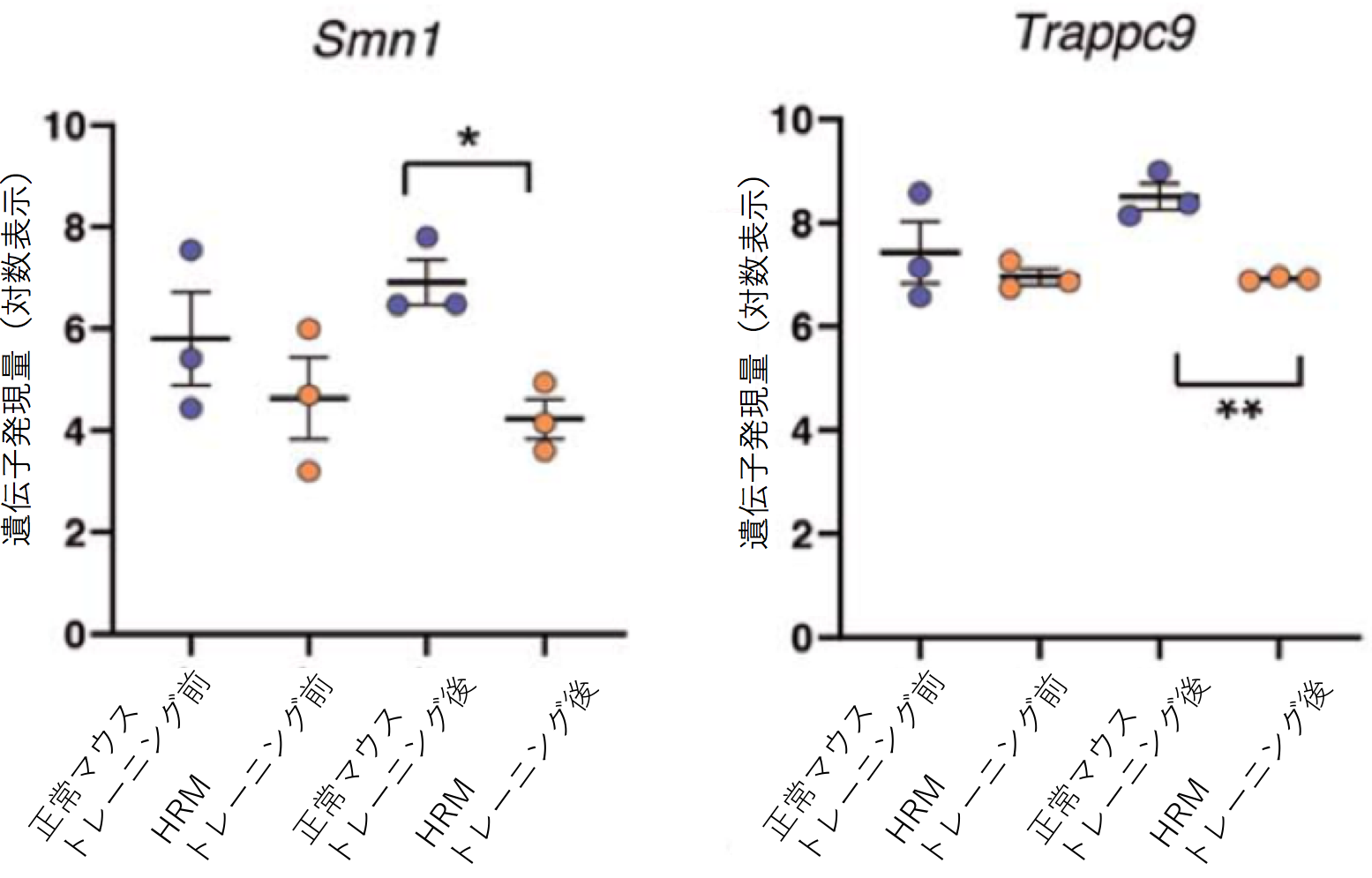
文責
解剖学講座(神経形態学部門) 勝山 裕
胃食道接合部の解剖、病態生理および臨床的意義に関する京都国際コンセンサス報告書
論文タイトル
Kyoto international consensus report on anatomy, pathophysiology and clinical significance of the gastro-oesophageal junction
掲載誌
Gut(2021年版 Impact Factor:31.793)
執筆者
Sugano K, Spechler SJ, El-Omar EM, McColl KEL, Takubo K, Gotoda T, Fujishiro M, Iijima K, Inoue H, Kawai T, Kinoshita Y, Miwa H, Mukaisho KI, Murakami K, Seto Y, Tajiri H, Bhatia S, Choi MG, Fitzgerald RC, Fock KM, Goh KL, Ho KY, Mahachai V, O'Donovan M, Odze R, Peek R, Rugge M, Sharma P, Sollano JD, Vieth M, Wu J, Wu MS, Zou D, Kaminishi M, Malfertheiner P.
(太字は本学の関係者)
論文概要
胃食道接合部(GOJ)以外に発生する胃炎については広くコンセンサスが得られているものの、GOJの解剖学的な位置、生理機能やGOJに発生する疾患等についての世界的なコンセンサスは得られていません。そこで今回、消化器専門の内科医を中心に外科医と病理医が集まり1)GOJを定義するための指標、2)胃噴門型粘膜の発生と病態生理学的意義、3)胃食道接合部領域(GOJZ)の定義、4)GOJZに発生する化生、炎症および腫瘍の原因等、についてコンセンサスを得るため、京都で国際会議を開催しました。デルファイ法を用いて、80%以上の一致を目標とし、2回の投票と修正の結果、28個の臨床的質問についてコンセンサスが得られました。特に強調すべきは以下の4点です。1)GOJを識別する内視鏡的指標は日本で用いられている柵状血管の下端とする(図1)。2) バレット食道は扁平上皮に代わり、悪性化しやすい化生円柱上皮におおわれた粘膜と定義する(図2)。3)胃噴門腺は先天的に非常に短い距離で存在し、食道胃逆流によって口側に、ピロリ菌感染によって肛門側に延長する(図3)。4)GOJZをGOJの近位1cmと遠位1cmにまたがる領域として新しく定義する。今回得られたコンセンサスが今後の研究に役立つとともに、GOJZの複雑な病態生理の理解を促進し、GOJZに発生する疾患の予防法や治療法の確立に貢献することが期待されます。
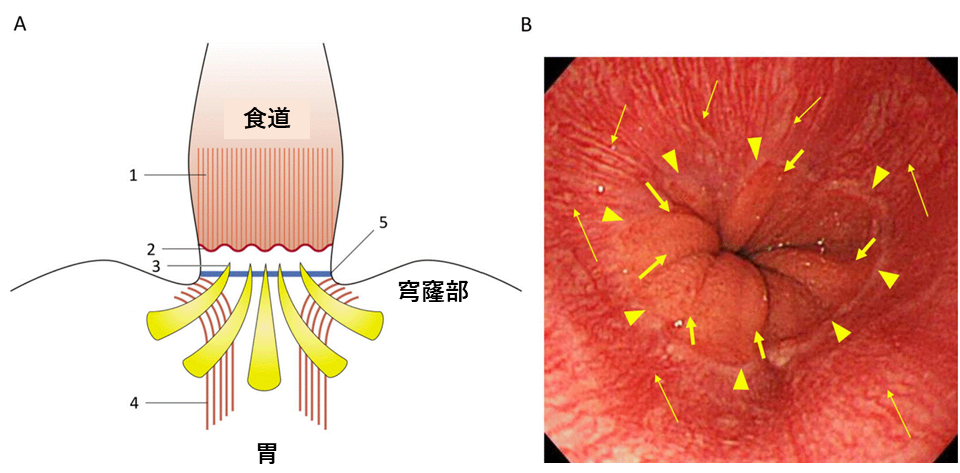
A:GOJに使用する指標のシェーマ。1)柵状血管、2)扁平上皮―円柱上皮接合線、3)胃粘膜ヒダの上端、4)胃の入口部,食道の左側にまたがるように位置する最も内側の筋束(内斜筋)、5)His角。
B:GOJの内視鏡像。柵状血管(細矢印。図1A-1に相当)、扁平上皮―円柱上皮接合線(矢頭。図1A-2の波線に相当)、胃粘膜ヒダの上端(太矢印。図1A-3に相当)を示します。健常者では、柵状血管の下端は、扁平上皮―円柱上皮接合線にほぼ一致し、胃粘膜ヒダの上端と密接に配列しています。
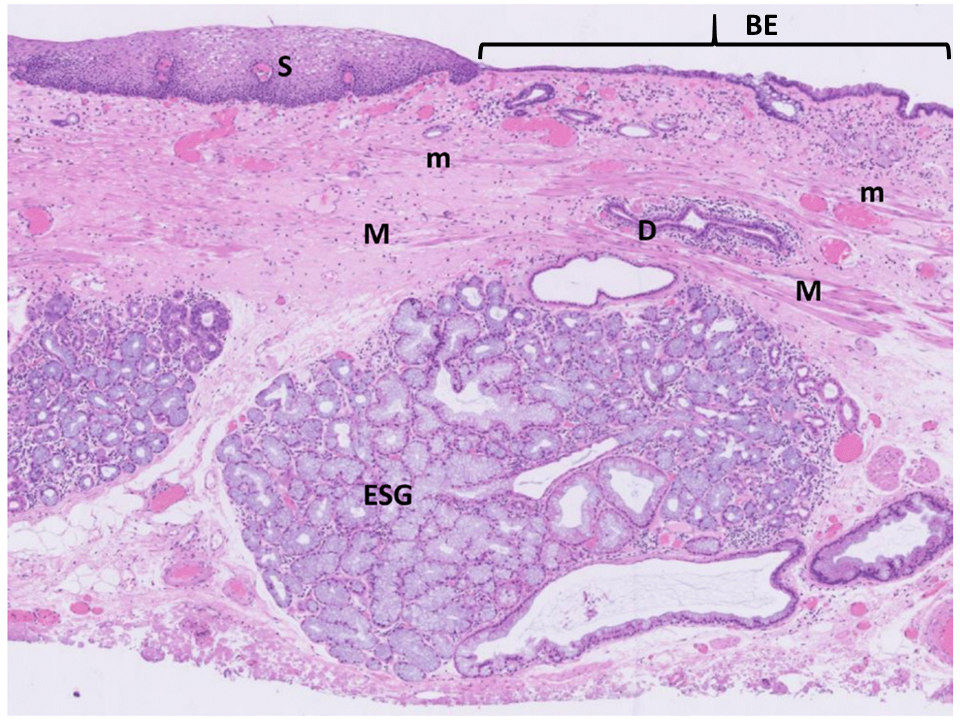
食道特有の組織学的特徴として表層粘膜筋板(m)と深層粘膜筋板(M)からなる二重筋板、扁平上皮(S)、食道腺(ESG)につながる導管(D)が描出されています。よって、図の右側の杯細胞を含む化生円柱上皮で覆われた部分は、本来は胃粘膜ではなく食道粘膜であったと考えられ、バレット食道(BE)と診断されます。(この組織写真の写真は向所が提供しました。)
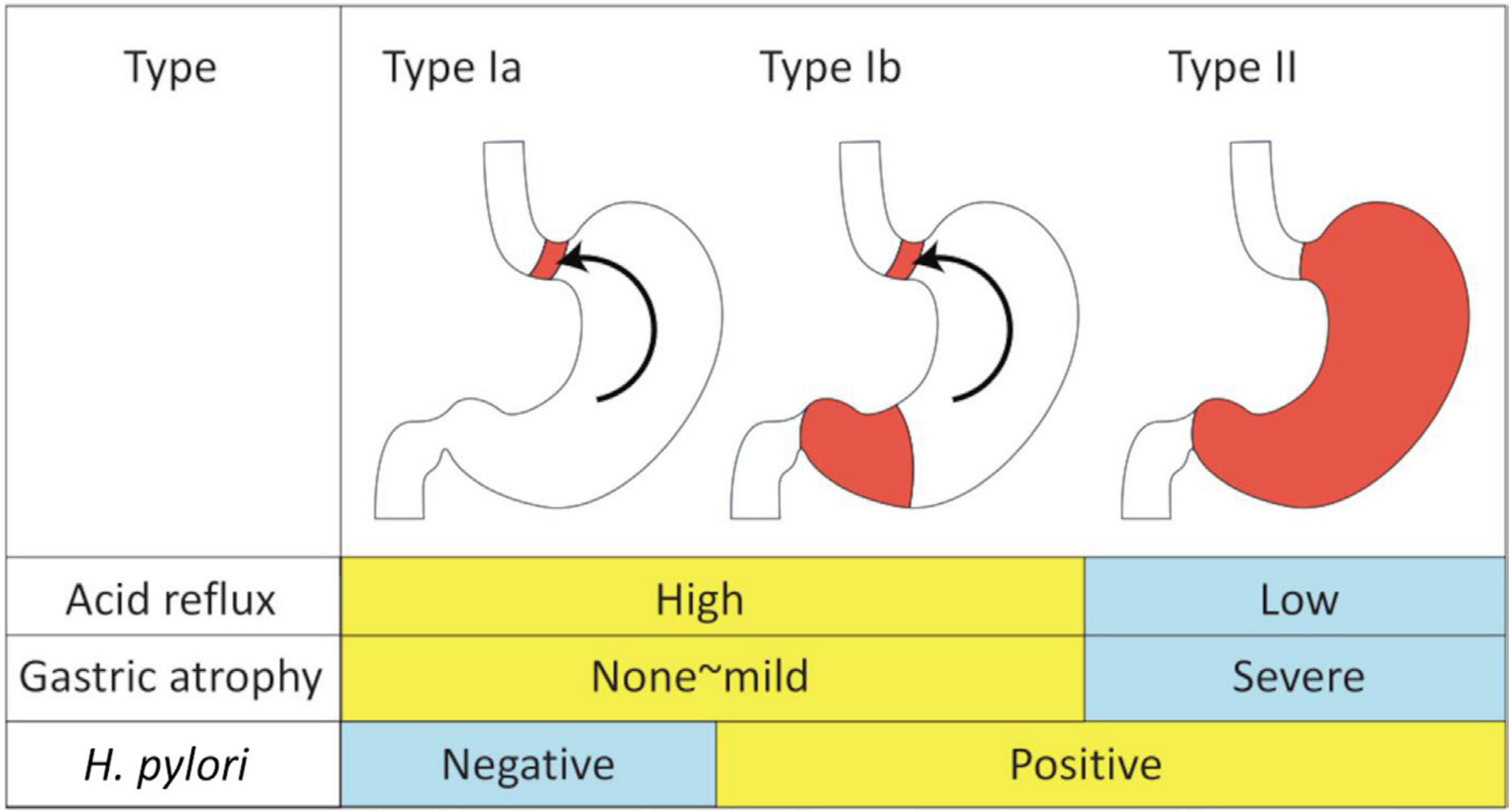
GOJZの円柱上皮化には、胃酸過多による胃十二指腸逆流(I型)とピロリ菌感染による萎縮の進行による低胃酸症・無胃酸症(II型)の2つの独立したメカニズムが想定されます。さらにI型は、胃の萎縮を伴わないピロリ菌に感染していない患者の胃十二指腸逆流(Ia型)と、軽度の胃炎を伴うピロリ菌感染患者の胃十二指腸逆流(Ib型)に細分化されます。胃食道接合部で発生するニトロソ化ストレスや酸化ストレスも炎症の一因となる可能性があります。ピロリ菌感染患者では、胃食道接合部周辺の炎症は胃体部より強く、萎縮性変化や化生の原因となることがあります。黒い矢印は逆流(胃酸および胆汁酸)を示します。朱色の部分は、炎症および/または化生粘膜を示します。
文責
医学・看護学教育センター 向所 賢一
タウによる二本鎖DNA損傷修復不全はin vitroでアルツハイマー病理を呈する
論文タイトル
Failure of DNA Double-Strand Break Repair by Tau Mediates Alzheimer's Disease Pathology in vitro
掲載誌
Communications Biology
執筆者
Megumi Asada-Utsugi、Kengo Uemura、Takashi Ayaki、Maiko T Uemura、Sumio Minamiyama、Ryota Hikiami、Toshifumi Morimura、Akemi Shodai、 Takatoshi Ueki、Ryosuke Takahashi、Ayae Kinoshita、and Makoto Urushitani
(太字は本学の関係者)
論文概要
アルツハイマー病患者さんの脳では、アミロイドβと過剰にリン酸化されたタウが繊維 化した凝集体(NFT)が蓄積して神経細胞が死んでしまいます。通常、タウは細胞骨格タン パク質である微小管に結合し微小管の安定化に働きますが、リン酸化されると微小管結合 能が低下します。近年、細胞骨格タンパク質は二本鎖DNA損傷(DSB)修復において重要な 働きを持つことが報告され、私たちはタウとDSBという新たな視点からNFT形成メカニズムの研究を行いました。この論文で、アルツハイマー病患者さんの脳でDSBが増加していること、リン酸化タウとDSBが共局在することを示しました(図1)。また、マウス初代神経細胞に薬剤でDSBを誘導すると、非リン酸化タウが核膜近傍に蓄積し微小管との結合を促進することを示しました。しかし、長時間のDSB誘導では、リン酸化タウが核膜近傍に蓄積してしまい神経細胞死が増加しました(図2)。マウス初代神経細胞で内在性タウを欠失させた状態でDSB誘導を行うとDSBが増加することから、DSB修復へのタウの関与が示唆されました(図3)。さらに、微小管重合阻害処置後にDSBを誘導すると、神経細胞全体にNFT様の不溶性高分子量タウの蓄積が認められました(図4)。これらの結果から、神経細胞におけるDSB修復というタウの新たな生理機能を発見し、NFT形成メカニズムの解明に繋がることが期待されます。
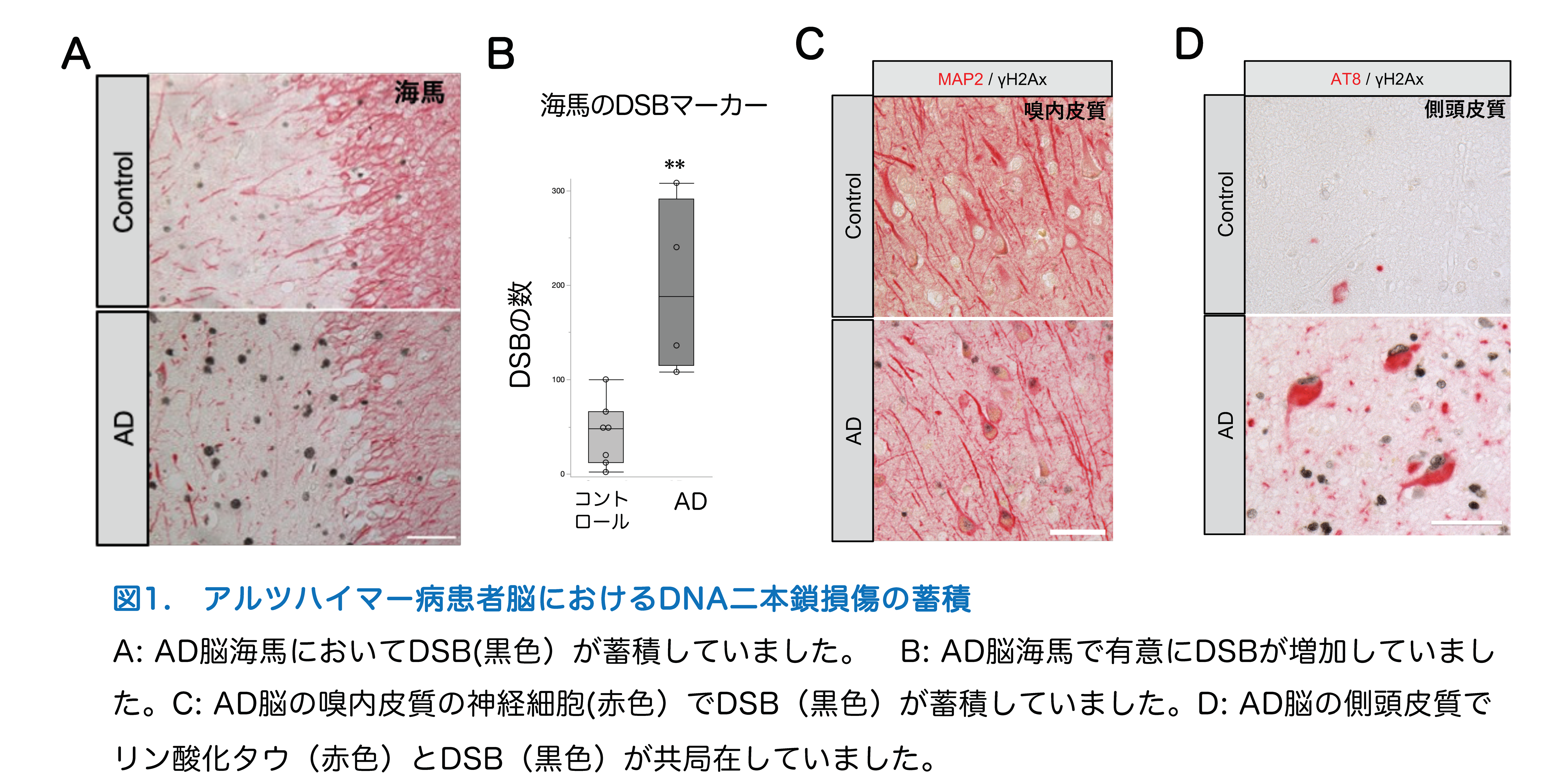
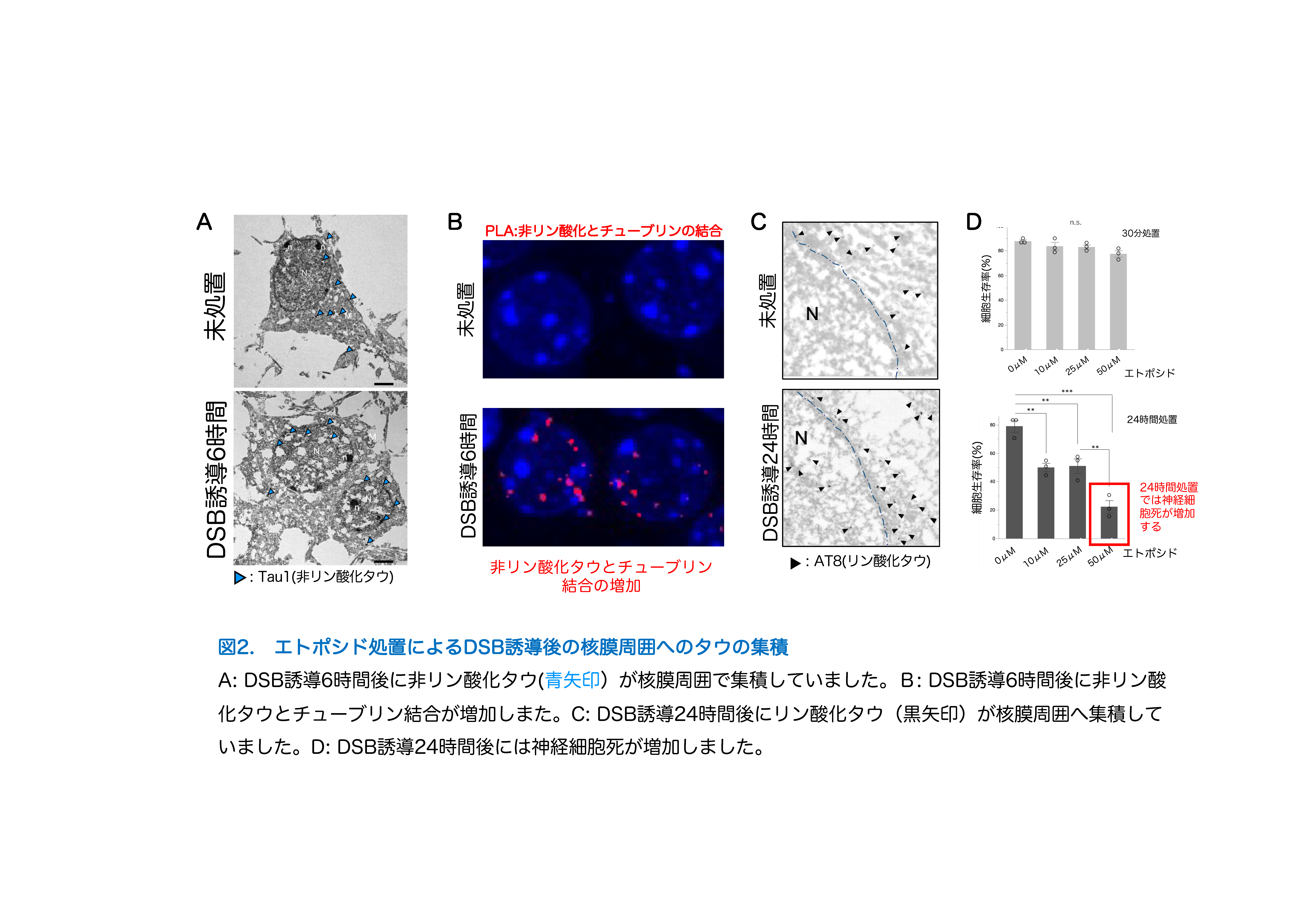
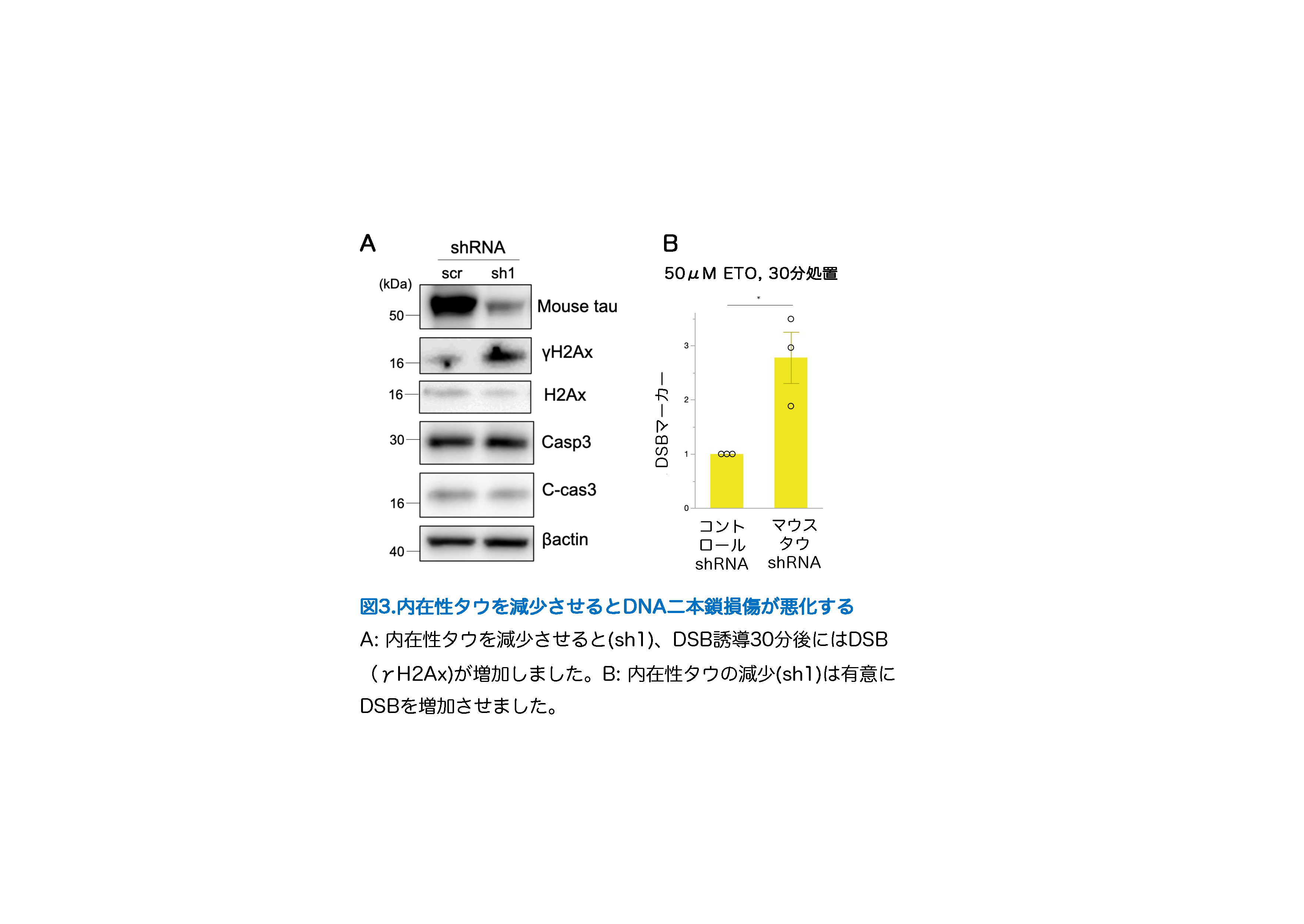
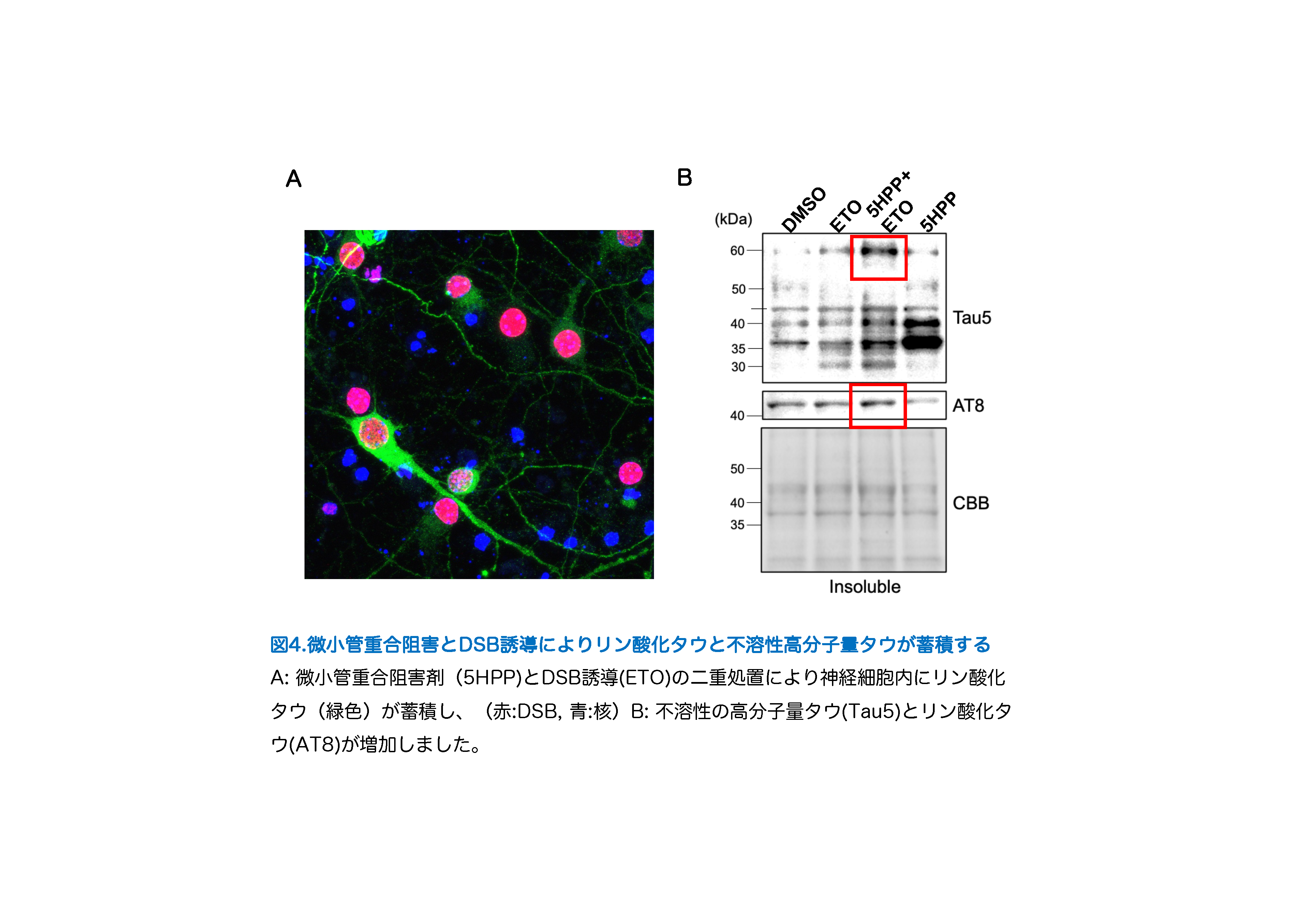
文責
神経難病研究センター臨床研究ユニット脳神経内科学部門 浅田 めぐみ
脂肪細胞のナルディライジンはUCP1の発現と体温恒常性を調節する
論文タイトル
Nardilysin in adipocytes regulates UCP1 expression and body temperature homeostasis
掲載誌
Scientific Reports 2022; 12: 3449.
執筆者
Sayaka Saijo、Mikiko Ohno、Hirotaka Iwasaki、Shintaro Matsuda、Kiyoto Nishi、Yoshinori Hiraoka、Natsuki Ide、Takeshi Kimura、Eiichiro Nishi
(太字は本学の関係者)
論文概要
哺乳類の体温恒常性は、体内での熱産生と体外への熱放散のバランスによって維持されています。熱産生、特に寒い時や食後の熱産生には褐色脂肪組織 (BAT) が重要です。BATは、通常ATP産生に使われるエネルギーを熱に変換する、脱共役タンパク質(UCP1)というチャネルタンパク質を発現しており、熱産生に特化した組織であるといえます。 私たちは以前、全身でナルディライジン (NRDC) というタンパク質を欠損したマウスは体温が低いこと、寒さに弱いこと、体外へ過剰に熱が放散されること、BATにおける熱産生が亢進していることを報告しました(Nat Commun 2014)。ところがNRDCが様々な臓器に発現していることから、どの臓器のNRDCが重要なのかはわかりませんでした。そこで本研究では、脂肪細胞特異的なNRDC欠損マウス(Adipo-KO)を解析した結果、Adipo-KOマウスは体温が高く、寒さに強いことを示しました(図1)。Adipo-KOマウスの熱放散は対照マウスと差がなく、BAT熱産生増加によって高体温を呈することが示唆されました。意外なことに、Adipo-KOでUCP1の遺伝子発現は低かったのですが、UCP1タンパク質がより安定化して熱産生が増えることが示唆されました。またNRDC欠損が、酸化ストレス上昇を介して熱産生を増加した可能性も示唆されました(図2)。今回の知見は、熱産生と体温恒常性維持の新しいしくみとして、Scientific Reportに報告しました。
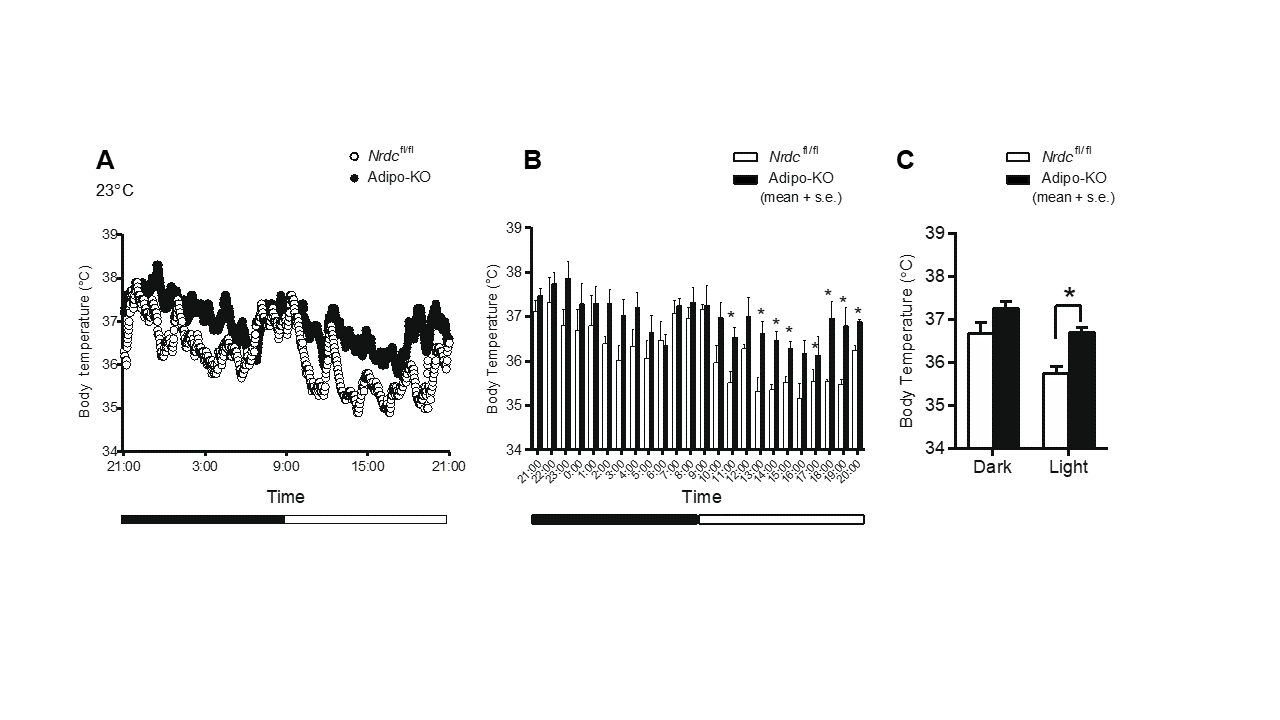
(A) 1分毎の平均値、(B) 1時間毎の平均値、(C) 12時間毎(夜間、日中)の平均値を示す。いずれも白色が対照マウス、黒色が脂肪細胞特異的NRDC欠損マウス(Adipo-KO)を示す。24時間を通してAdipo-KOで体温が高めだが、特に日中は有意に高体温を呈した。
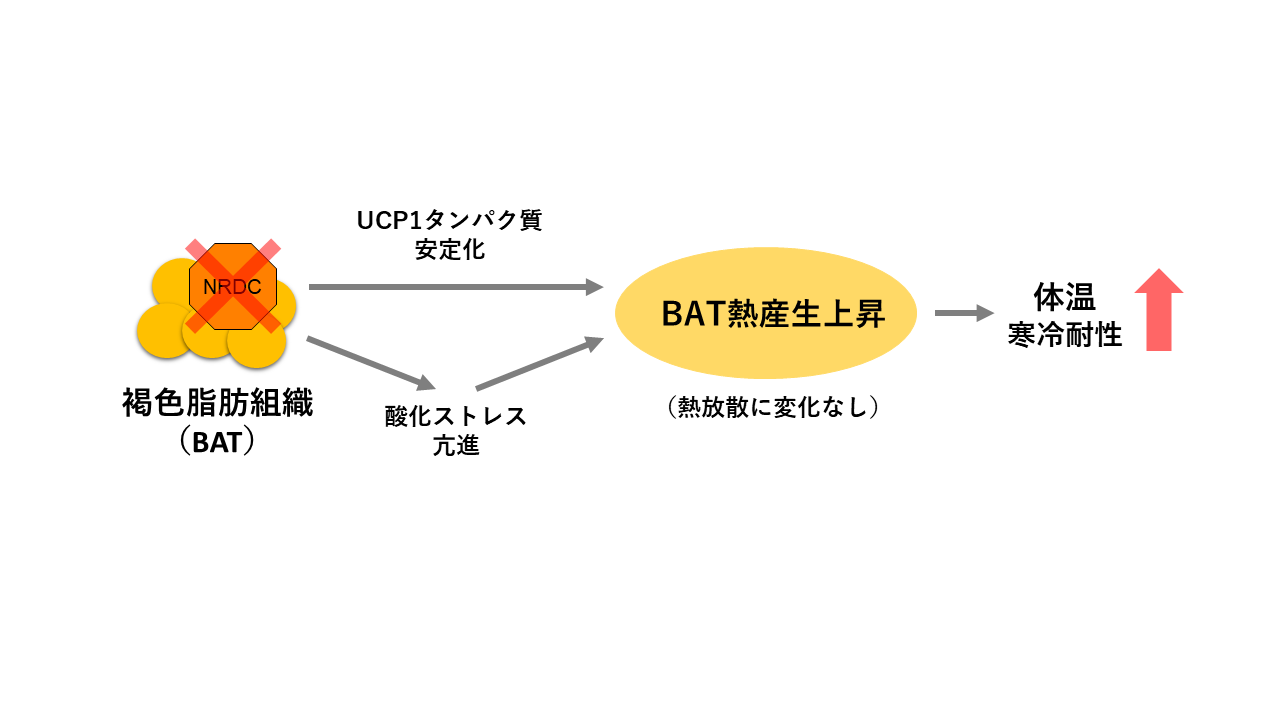
文責
薬理学講座 西 英一郎
アミロイドβ産生を抑制するFAM3Cはアルツハイマー病患者の脳において転写が阻害されることにより発現が減少する
論文タイトル
Transcriptional downregulation of FAM3C/ILEI in the Alzheimer’s brain
掲載誌
Human Molecular Genetics, 2022, Vol. 31, No. 1
執筆者
Naoki Watanabe、Masaki Nakano、Yachiyo Mitsuishi、Norikazu Hara、Tatsuo Mano、Atsushi Iwata、Shigeo Murayama、Toshiharu Suzuki、Takeshi Ikeuchi、Masaki Nishimura
(太字は本学の関係者)
論文概要
アルツハイマー病はアミロイドβが脳内に蓄積することによって引き起こされます。私たちは、脳のアミロイドβ産生を抑制する機能をもつ分子FAM3C(または ILEI)を見出し解析を続けています。FAM3Cは健常な神経細胞のシナプス部分に豊富に発現し、神経活動に伴いアミロイドβとともに細胞外へ分泌されます(図1)。しかし、アルツハイマー病症例の脳ではFAM3Cの発現レベルが低下しています(図2A)。この論文では、そのメカニズムを詳細に解析しました。通常、遺伝情報は遺伝子DNAからメッセンジャーRNA、次いでタンパク質へと読み出されますが、アルツハイマー病ではFAM3C遺伝子からRNAへの段階(転写)が阻害されていることを明らかにしました。また、この段階ではSP1とEBF1とよばれる2因子が主に働くこと、アルツハイマー病ではこの2因子が神経細胞の核内で減少し、2因子のDNA結合効率が低下していることも見出しました(図2B&C)。これらの結果から、2因子の異常な状態を改善させることが有効な治療法につながる可能性が示唆されました。
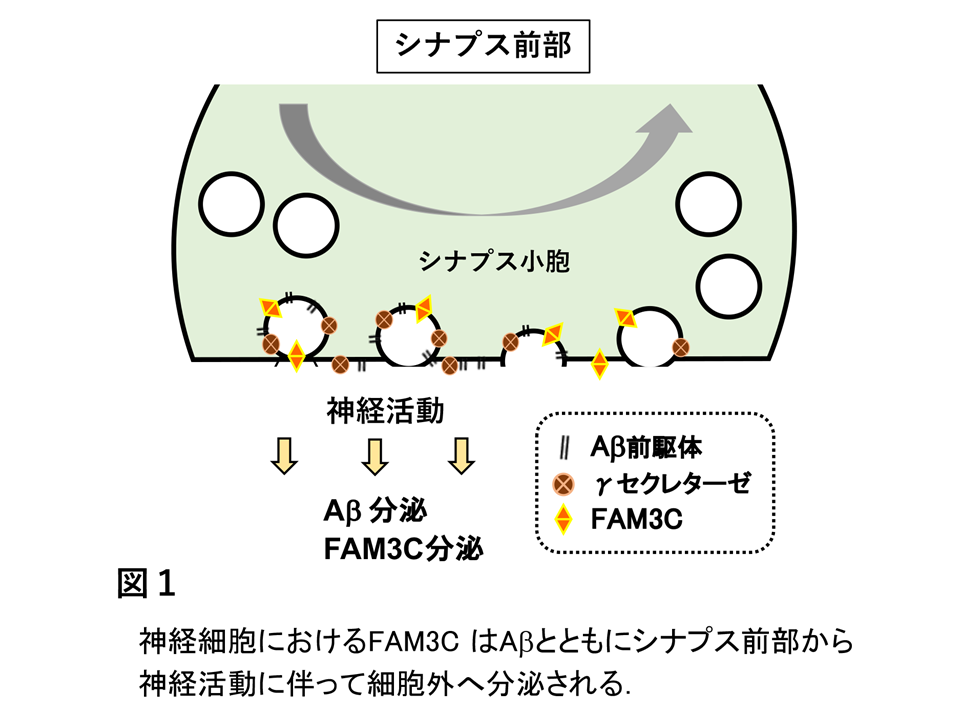
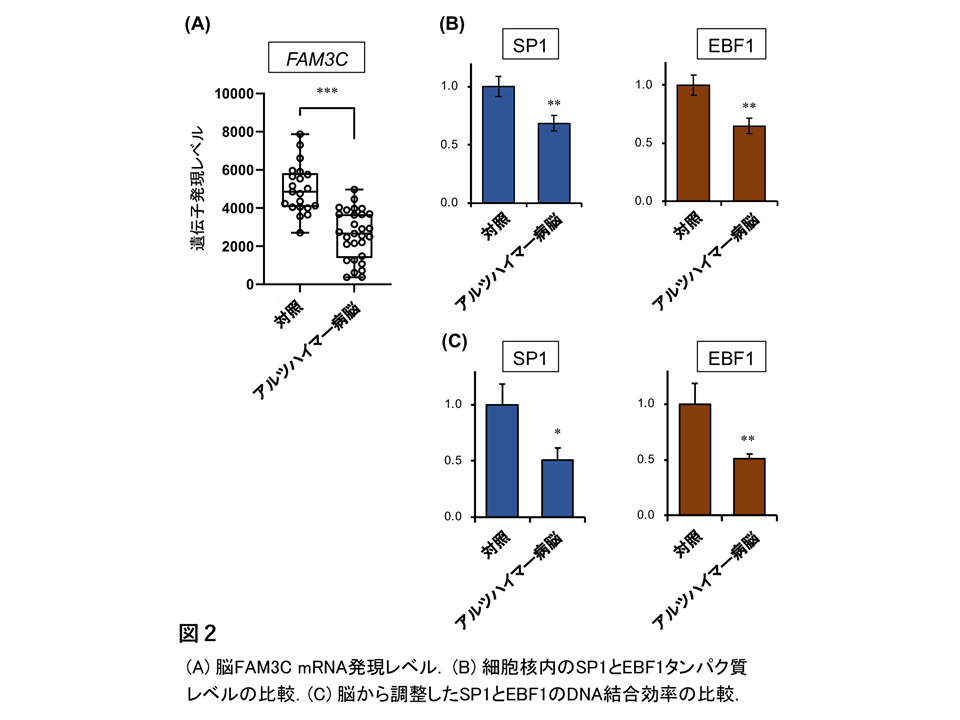
文責
神経難病研究センター 西村正樹
カニクイザルの腫瘍拒絶モデルにおいて腫瘍に浸潤したT細胞や末梢血中のT細胞から腫瘍殺傷能力をもつT細胞受容体遺伝子の単離
論文タイトル
Isolation of TCR genes with tumor-killing activity from tumor-infiltrating and circulating lymphocytes in a tumor rejection cynomolgus macaque model
掲載誌
Molecular Therapy – Oncolytics
執筆者
寺田晃士、近藤健太、石垣宏仁、長嶋彩花、里岡大樹、永野誠治、増田喬子、川村晃久、平田多佳子、小笠原一雅、伊藤 靖、河本 宏、縣 保年
(太字は本学の関係者)
論文概要
ヒトのがん免疫療法では、マウスで観察されなかった副作用がみとめられる例があることから、非ヒト霊長類を用いた研究が必要です。そこでカニクイザルの腫瘍細胞を移植する実験系を用いて、腫瘍細胞をサルに移植すると2週ほどで腫瘍が形成されますが、腫瘍は4〜5週で消失することがわかりました。これまでにヒトの症例では、PD-1を発現するT細胞が腫瘍反応性を有することが報告されています。そこで本研究では、移植2週間後に腫瘍に浸潤したT細胞のうち、PD-1を発現するT細胞を分取し、T細胞が腫瘍細胞を認識し殺傷するために重要な役割を果たすT細胞受容体(TCR)の遺伝子を単離しました(図1、2)。次に、単離したTCR遺伝子を、ヒトのiPS細胞から再生した細胞傷害性T細胞(再生T細胞)に発現させ、腫瘍細胞に対する細胞傷害活性を検討しました。その結果、出現頻度の高いTCRは腫瘍細胞に対して高い細胞傷害活性を示したのに対して、出現頻度の低いTCRは細胞傷害活性を示すものは少ないことがわかりました(図3)。さらに細胞傷害活性を示したTCRを発現させた再生T細胞は、免疫不全マウスを用いた動物実験でも抗腫瘍活性を示しました(図4)。これらの結果から、このサルの腫瘍移植モデルにおいて、腫瘍浸潤 T細胞は腫瘍細胞を殺傷する能力を有し、腫瘍の消失に寄与することが示唆されるとともに、この方法をヒトの治療に応用できる可能性が示されました。
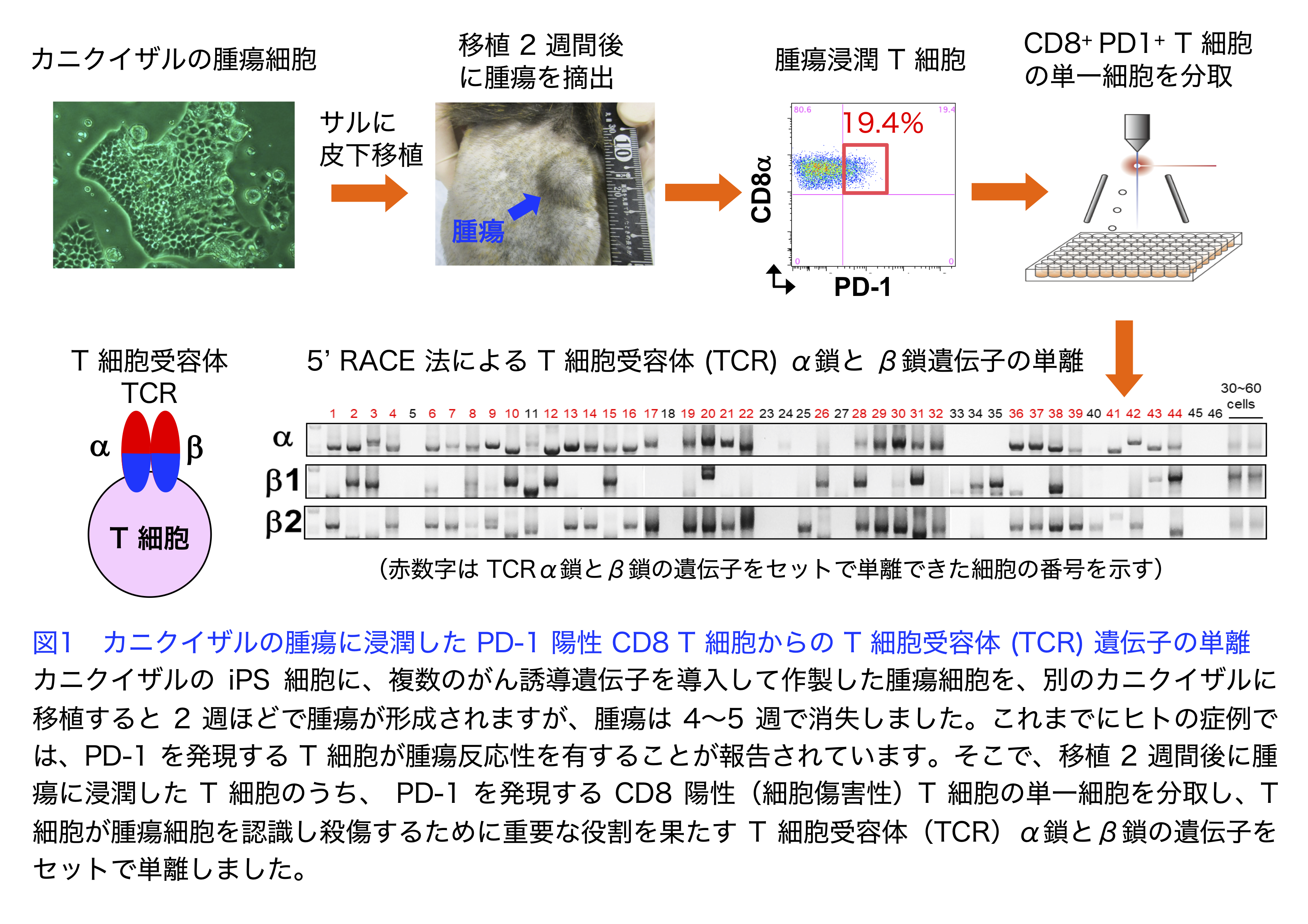

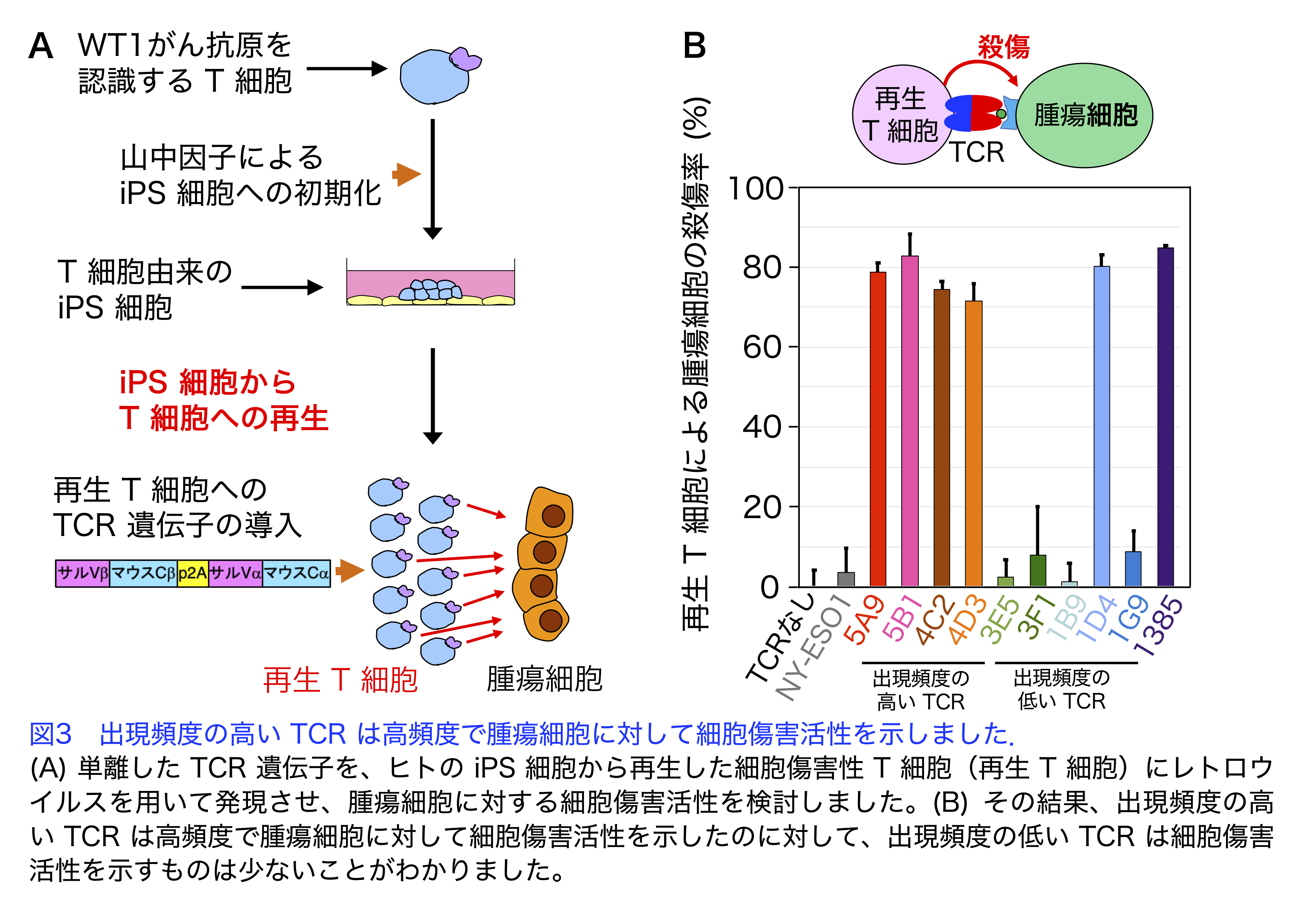
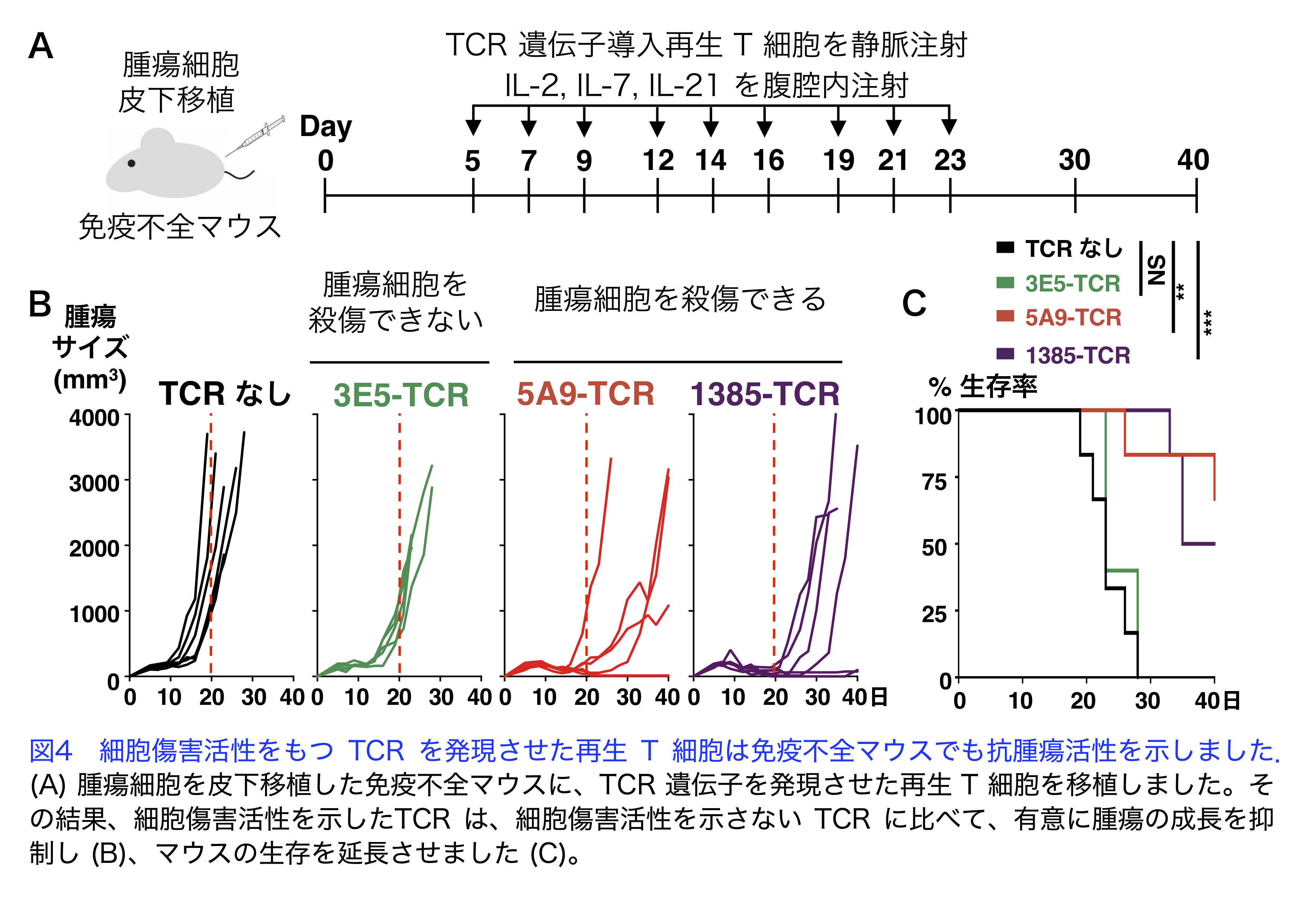
文責
生化学・分子生物学講座(分子生理化学部門) 縣 保年、寺田晃士
ジペプチジルペプチダーゼIIIは糖尿病マウスにおいて心・腎保護作用を発揮する
論文タイトル
Cardio- and reno-protective effects of dipeptidyl peptidase III in diabetic mice.
掲載誌
Journal of Biological Chemistry. 2021; 296: 100761.
執筆者
Komeno M, Pang X, Shimizu A, Molla MR, Yasuda-Yamahara M, Kume S, Rahman NIA, Soh JEC, Nguyen LKC, Ahmat Amin MKB, Kokami N, Sato A, Asano Y, Maegawa H, Ogita H.
(太字は本学の関係者)
論文概要
糖尿病は様々な合併症を引き起こします。特に、心臓や腎臓への障害(ダメージ)は致命的となることがあります。これまでに私たちは高血圧モデルマウスにおいてペプチド分解酵素であるジペプチジルペプチダーゼIII(DPPIII)が血圧降下機能を発揮することを見出しました。しかし、糖尿病におけるDPPIIIの役割については不明でした。そこで本研究ではDPPIIIを糖尿病モデルマウスに投与した場合の効果について検討しました。DPPIIIを糖尿病マウスの静脈内へ投与すると、血糖値の変化は見られなかったものの、糖尿病による心臓、腎臓への障害を軽減できました(図1)。次に、DPPIIIがどの様な血中ペプチドを分解してこの軽減作用を発揮しているか、血中の全ペプチドを対象にしたペプチドミクス解析を行って調べました。その解析過程で、糖尿病マウスの血中で増加しているペプチドの中から3つまで候補(ペプチド1、ペプチド2、ペプチド3)を絞り、最終的に、免疫機能に関わる補体C3の一部分に相当する「ペプチド2」(9アミノ酸で構成)が、DPPIIIによって2アミノ酸と7アミノ酸の2つに速やかに分解されることを見つけました(図2)。ペプチド2は血管の内側を覆う内皮細胞の表面に発現する受容体と結合してアナフィラキシー様作用をもたらすことや、それに応じて血管透過性が高まり炎症細胞などの遊走が増加することを見出しました。この結果、炎症細胞などが過剰に心臓、腎臓に蓄積しやすくするなどの悪影響が生じ、糖尿病による心臓、腎臓への障害をさらに悪化させることが示唆されました(図3)。DPPIIIによってペプチド2を分解したり、ペプチド2が受容体を介して細胞内シグナル伝達機構を活性化する経路を遮断すると、この悪影響は抑制されました。以上、DPPIIIが臓器障害を起こす血中のペプチド2を分解して心・腎保護作用を発揮するメカニズムを、主に、糖尿病マウスを活用することで明らかにしました。今後は、この成果を新たな糖尿病合併症治療開発に発展できればと考えています。
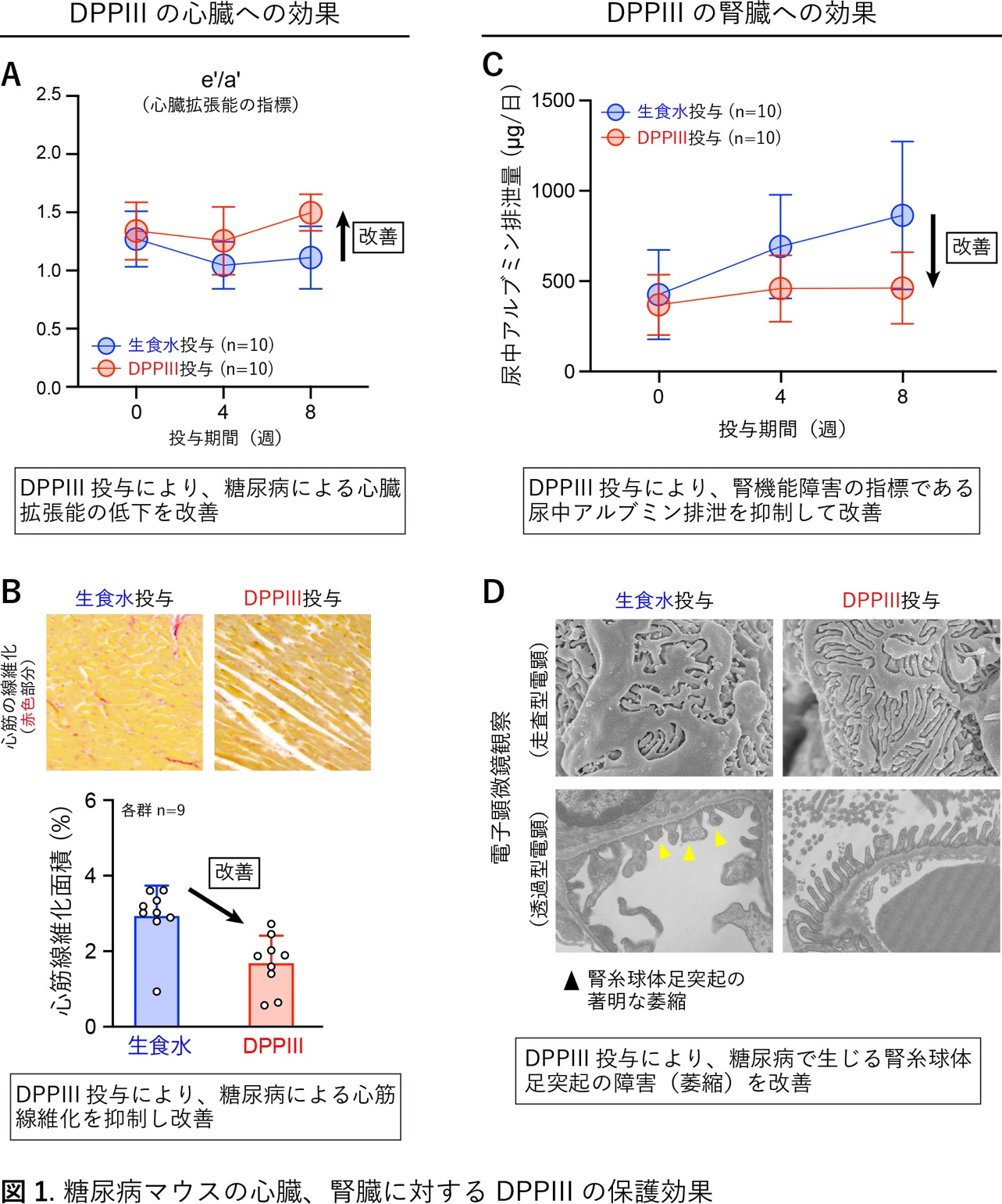
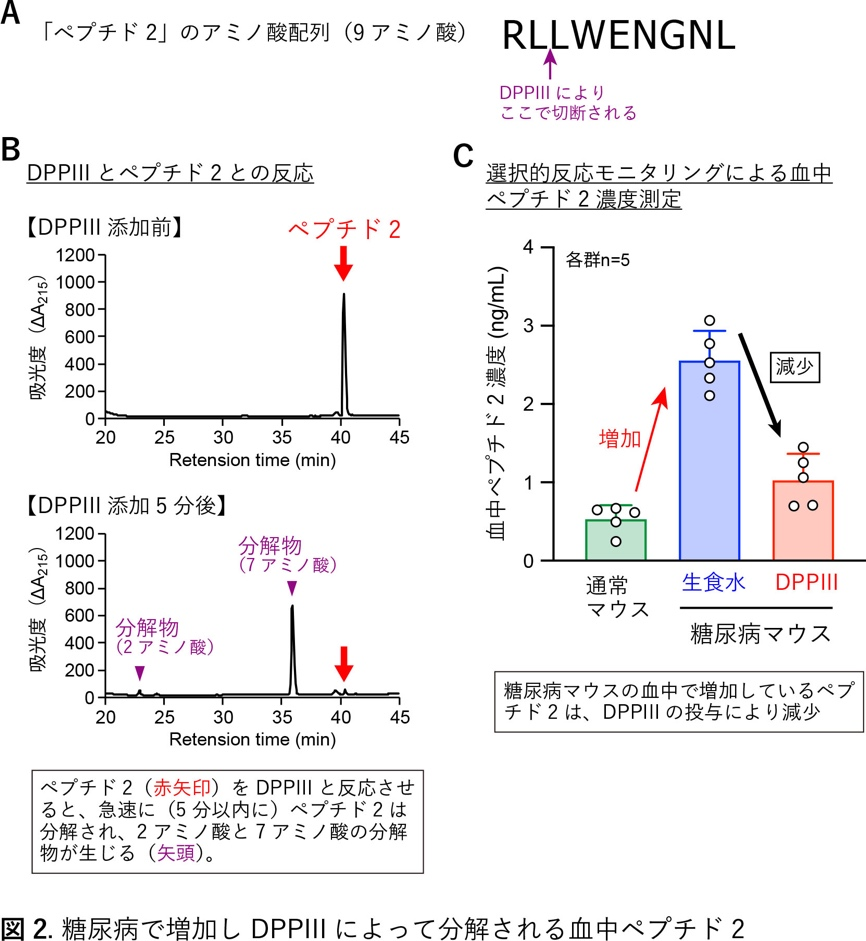
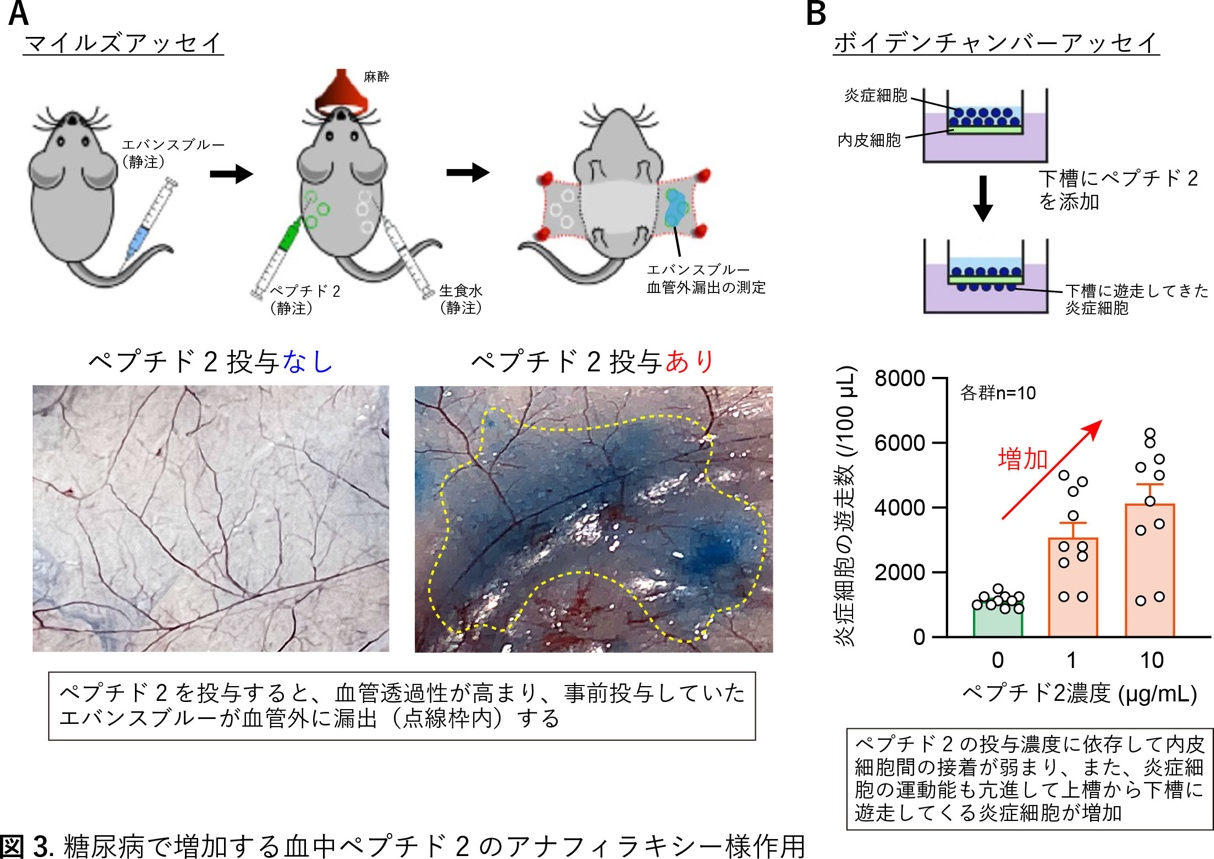
文責
生化学・分子生物学講座(分子病態生化学部門) 扇田久和
ストマチンはAktシグナルを抑制してがんの増大を阻止する
論文タイトル
Stomatin-mediated inhibition of the Akt signaling axis suppresses tumor growth
掲載誌
Cancer Research. 2021; 81: 2318-2331.
執筆者
Nor Idayu A. Rahman, Akira Sato, Khurelbaatar Tsevelnorov, Akio Shimizu, Masahiro Komeno, Mohammad Khusni Bin Ahmat Amin, Md Rasel Molla, Joanne Ern Chi Soh, Le Kim Chi Nguyen, Akinori Wada, Akihiro Kawauchi, Hisakazu Ogita
(太字は本学の関係者)
論文概要
生体内に生じたがんは周囲に存在する様々な細胞や物質から影響受けることで、より悪性化したり、逆に、がんの成長が抑制されたりします。この状態(がん細胞とその周囲の細胞が混在する状態)を模倣する実験系において、ストマチンががん細胞で多く発現していることを発見しました。ストマチンを発現していない前立腺がんLNCaP細胞にストマチンを強制的に発現させると、がん細胞の増加は止まり、この細胞をマウスに移植してできた腫瘍は小さくなりました(図1)。逆に、ストマチンを発現している前立腺がん22Rv1細胞でストマチンの発現を少なくすると、がん細胞の増加は早くなり、マウスに移植してできた腫瘍は大きくなりました(図1)。このことから、ストマチンががんの増大を阻止する作用を持つことが新たに分かりました。また、悪性度の低い(グリーソンスコアの低い)前立腺がん患者のがん組織ではストマチンの発現は多く、ストマチンの発現が多いと術後再発は少なくなりました(図2)。さらに、ストマチンがどのようにがんの増大を阻止しているか、そのメカニズムを検討したところ、ストマチンはPDPK1(Akt活性化を促すリン酸化酵素)の発現を減らして、最終的に細胞機能を調節する主要な分子であるAkt の活性化を抑制し、がん細胞の増殖を弱めると共に細胞死(アポトーシス)を強めていることが分かりました(図3, 4)。以上より、今回の研究でストマチンががんの増大を阻止していることと、その分子メカニズムを明らかにすることができました。
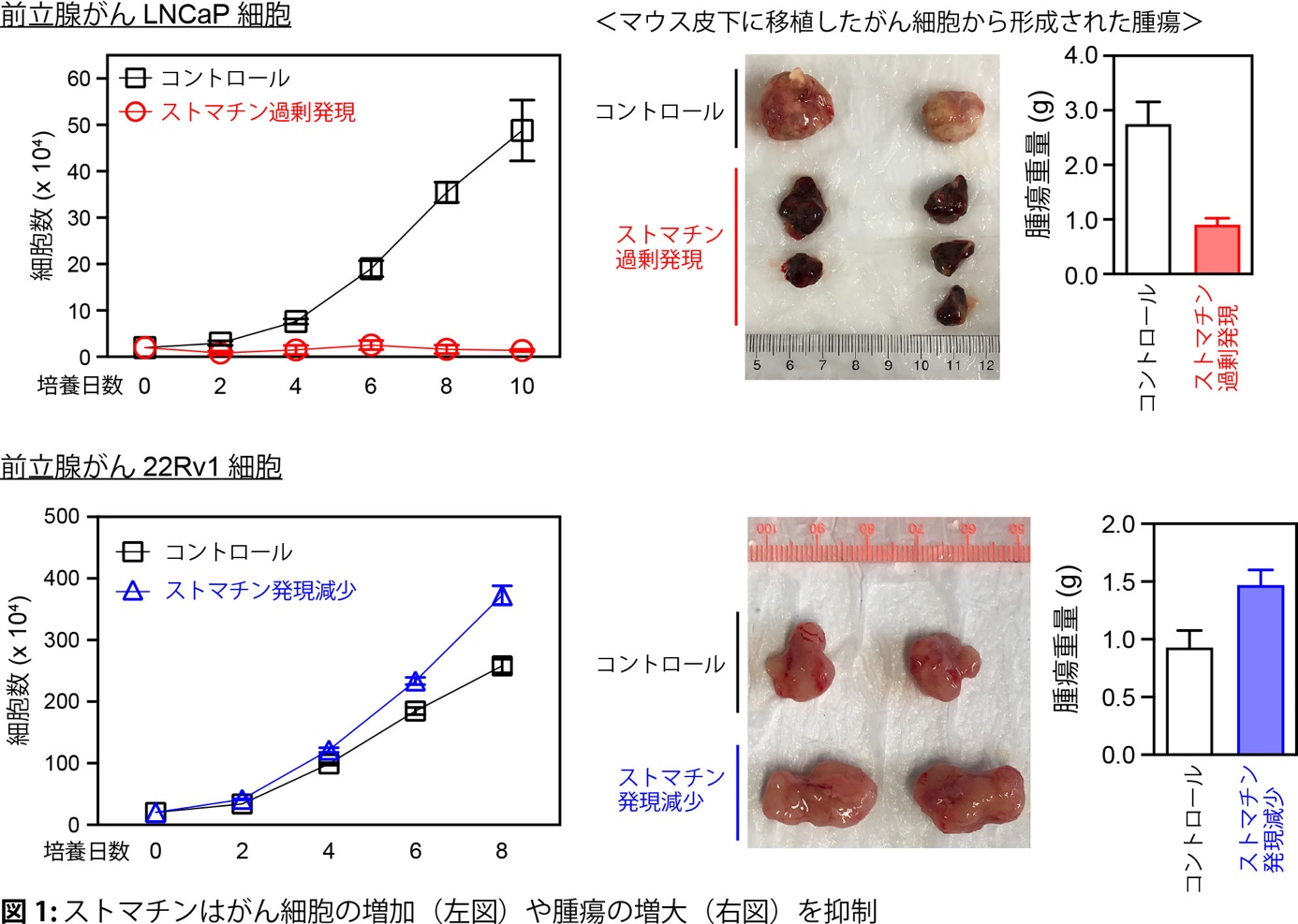
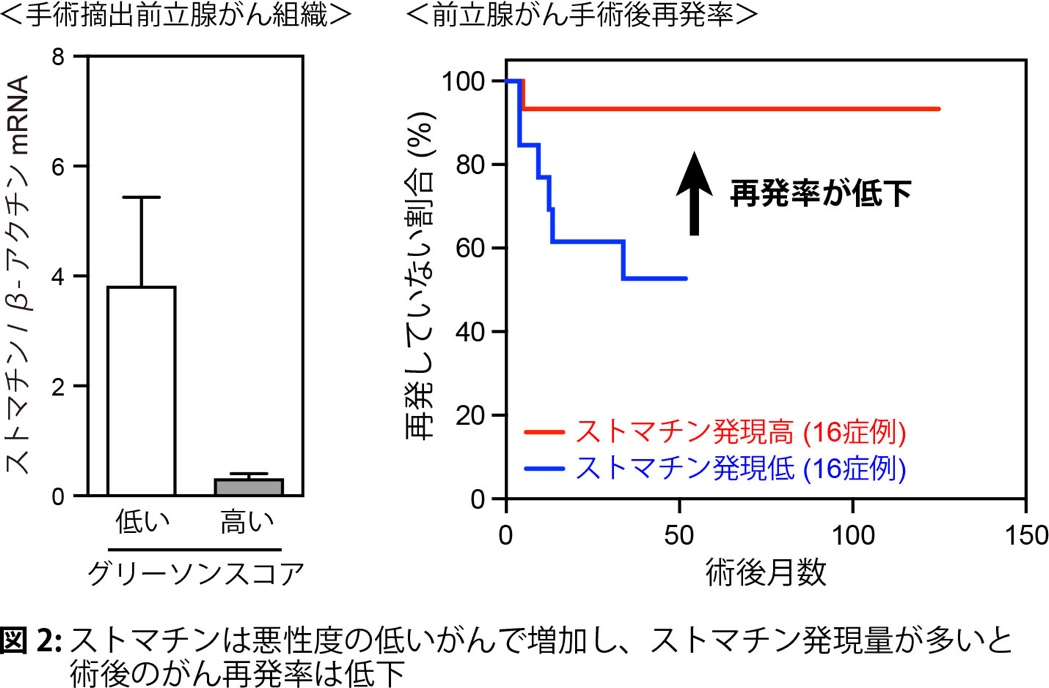
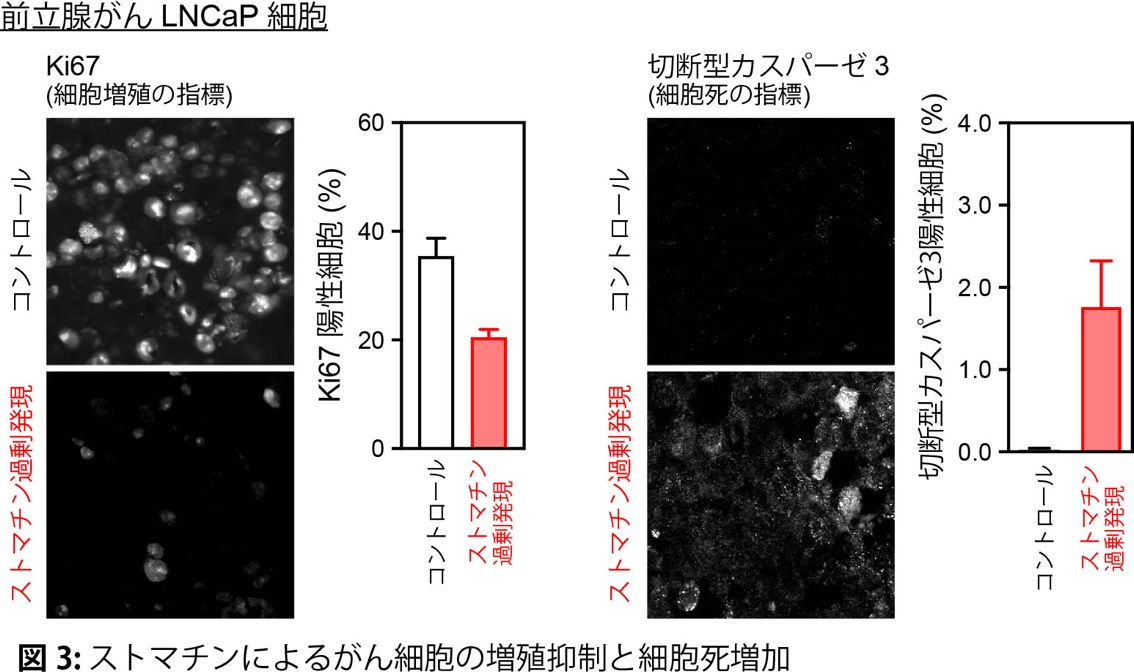
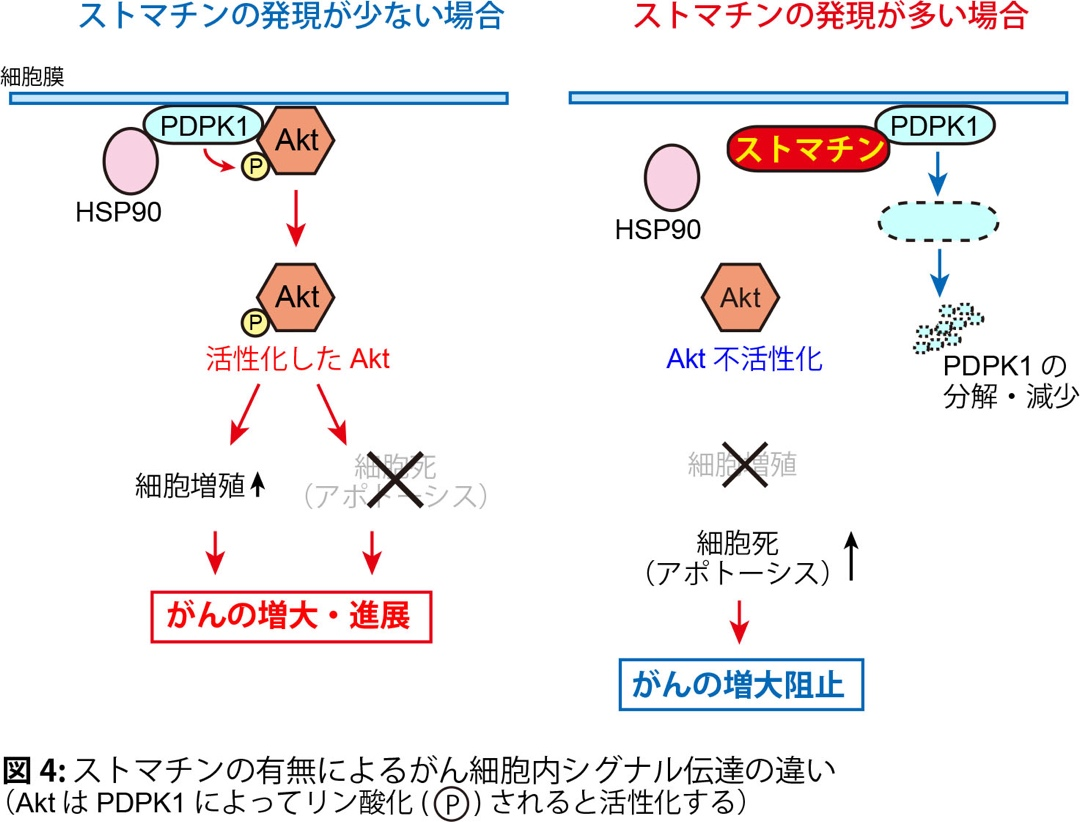
文責
生化学・分子生物学講座(分子病態生化学部門) 扇田久和、佐藤朗
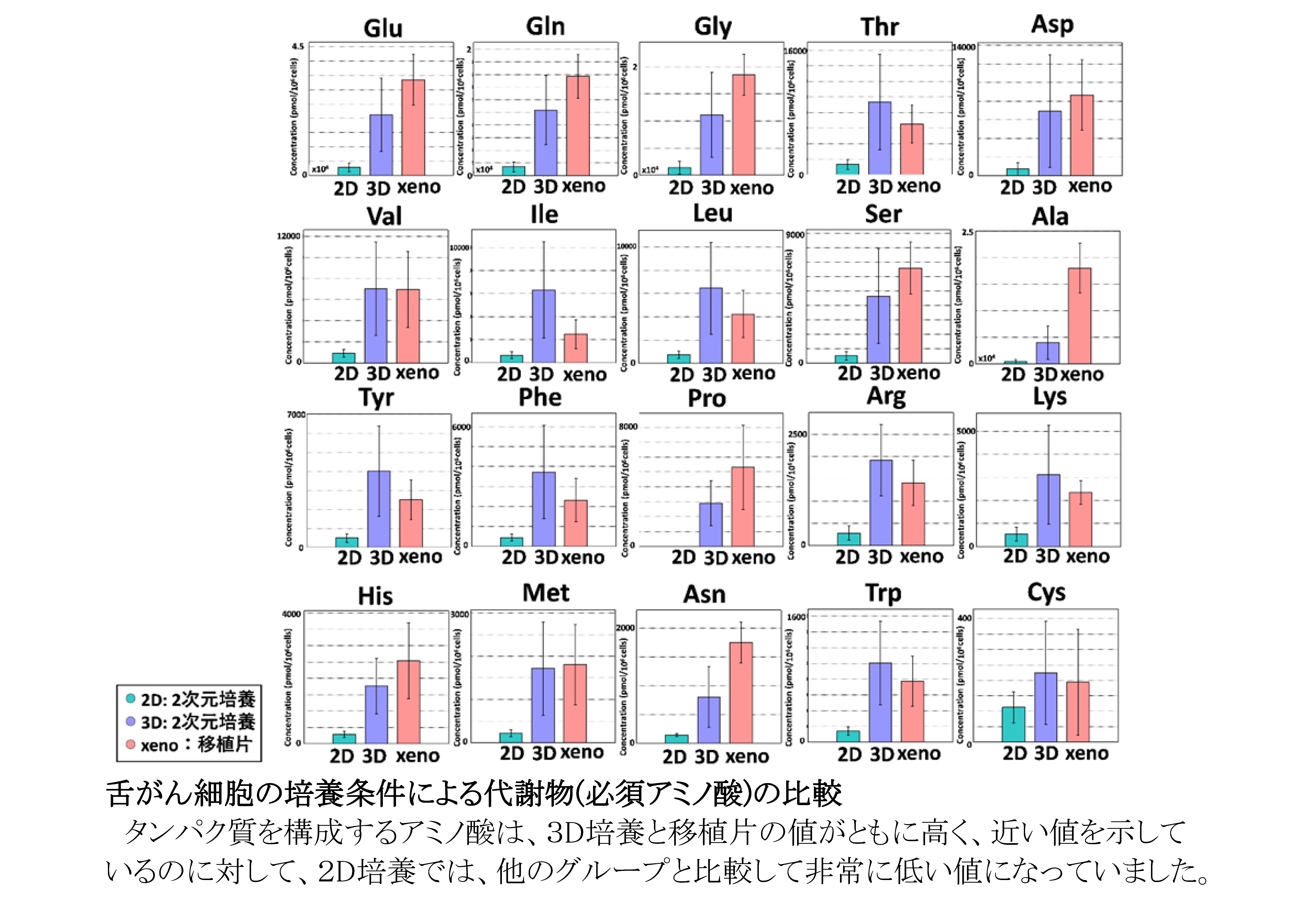
2D培養、3D培養、異種移植片における舌がん細胞代謝物の類似点と相違点
論文タイトル
Similarities and differences in metabolites of tongue cancer cells among two- and three-dimensional cultures and xenografts
掲載誌
Cancer Science
執筆者
Shoko Murakami, Hiroyuki Tanaka, Takahisa Nakayama, Naoko Taniura, Toru Miyake, Masaji Tani, Ryoji Kushima, Gaku Yamamoto, Hiroyuki Sugihara, Ken-ichi Mukaisho
(太字は本学の関係者)
論文概要
従来からの2次元(2D)培養では、がん細胞は生体内のがんと違った構造や機能を示すことが報告されてきました。今回、4種の舌がん細胞株を用いて、2D培養群、3次元(3D)培養群、舌癌細胞をヌードマウスに移植したxenograft(移植片)群の3群を作成し、網羅的な代謝解析を行いました。3D培養は、我々が日本バイリーン株式会社と共同開発した”Tissueoid cell culture system”を用いました。足場として高純度シリカファイバーからなる線維集合体であり、生体の疎性結合組織に類似したCellbedTMを用いました。このシステムで培養すると、細胞はCellbed内の空隙を通り自由に移動して生体がん組織に近い立体構造を呈します。代謝解析はヒューマン・メタボローム・テクノロジーズ株式会社に委託しました。その結果、2Dと3Dではがん代謝物は大きく異なっていましたが、3Dの代謝物の多くは移植片の代謝物と類似していました。また、3Dと移植片の結果から、がん細胞はグルコースなどの栄養素を使って解糖系やTCA回路を活性化することにより、biomass(細胞を構成する成分)の生合成、 酸化的リン酸化によるATP産生、酸化還元バランスの維持を行っていることを明らかにしました。さらに、我々の3D培養系で増殖したがん細胞は、生体がん組織の形態を模倣するだけではなく、機能的にも生体がん組織に近いことを見出しました。今後、がん研究の広い分野で、我々が開発した3D培養系が活用され、様々ながんの病態解明に寄与することを期待します。
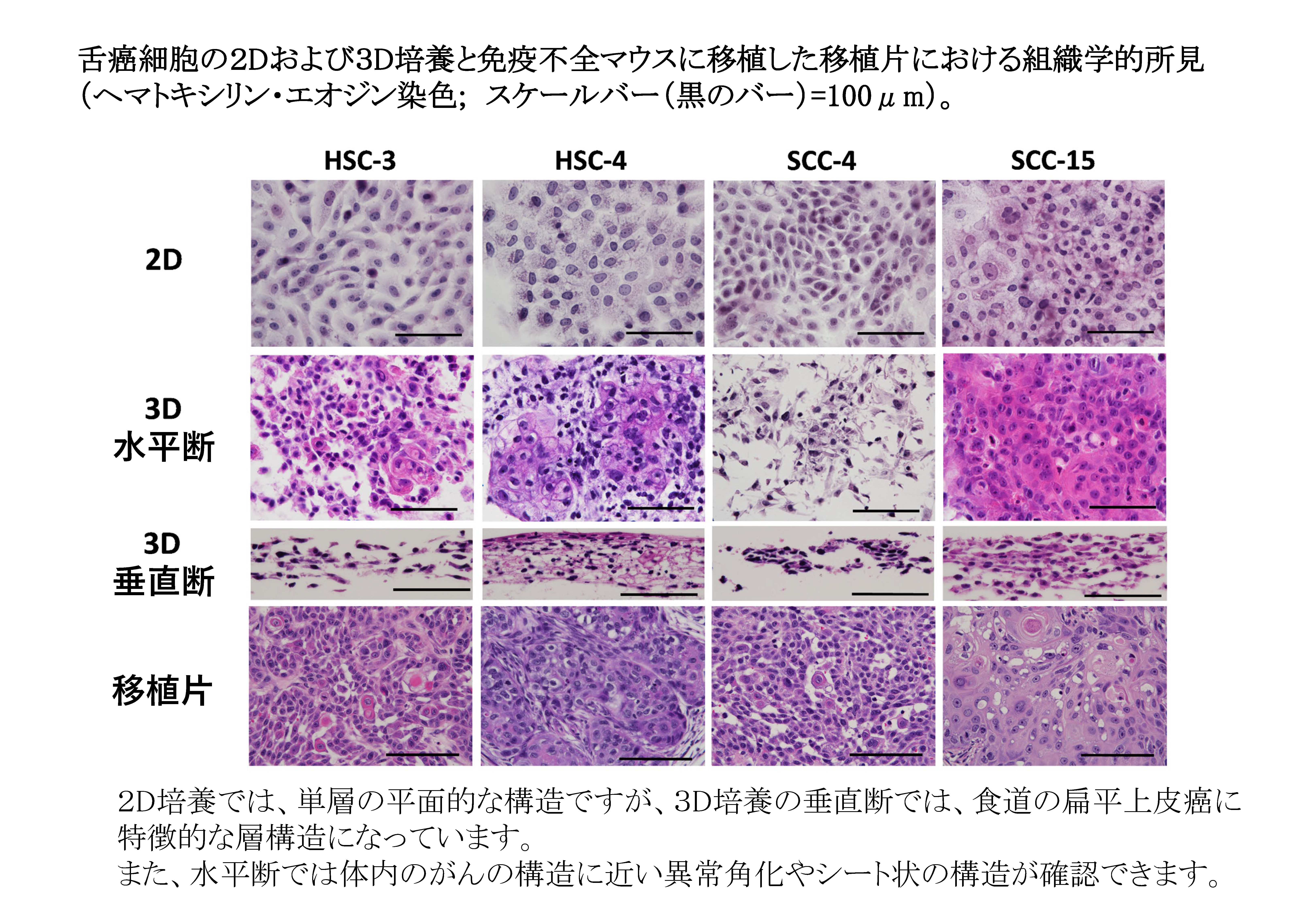
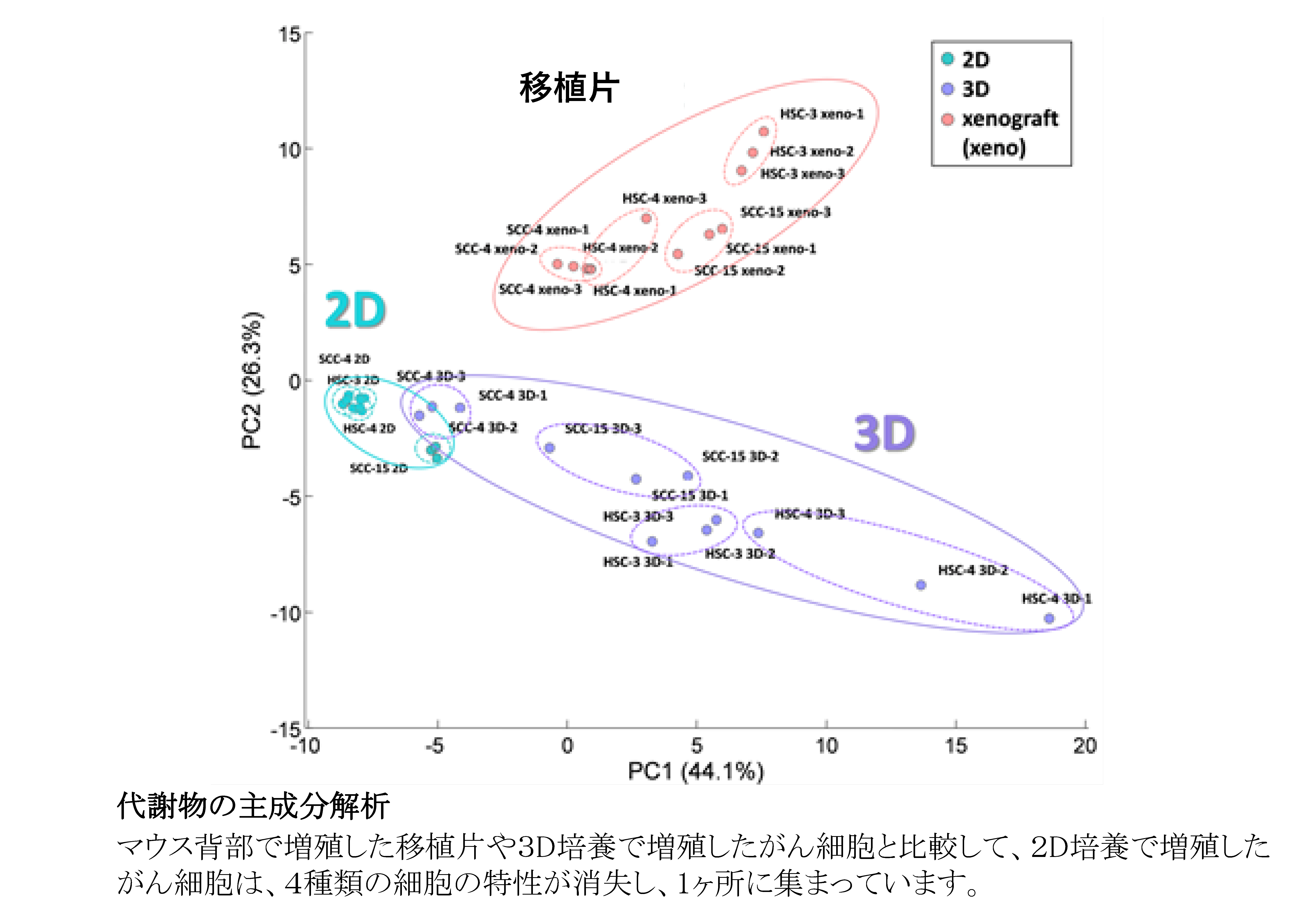
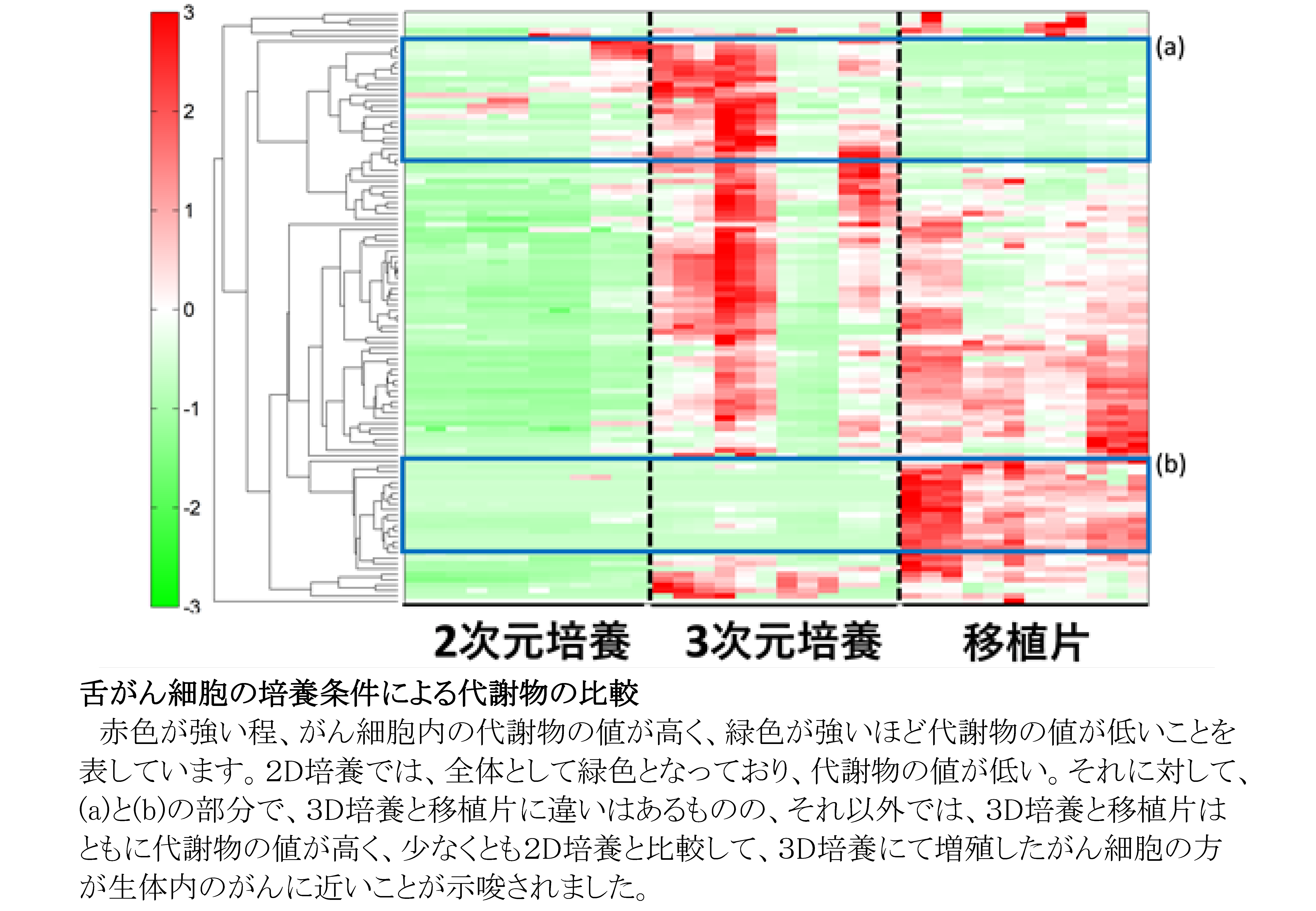

文責
医学・看護学教育センター 向所 賢一
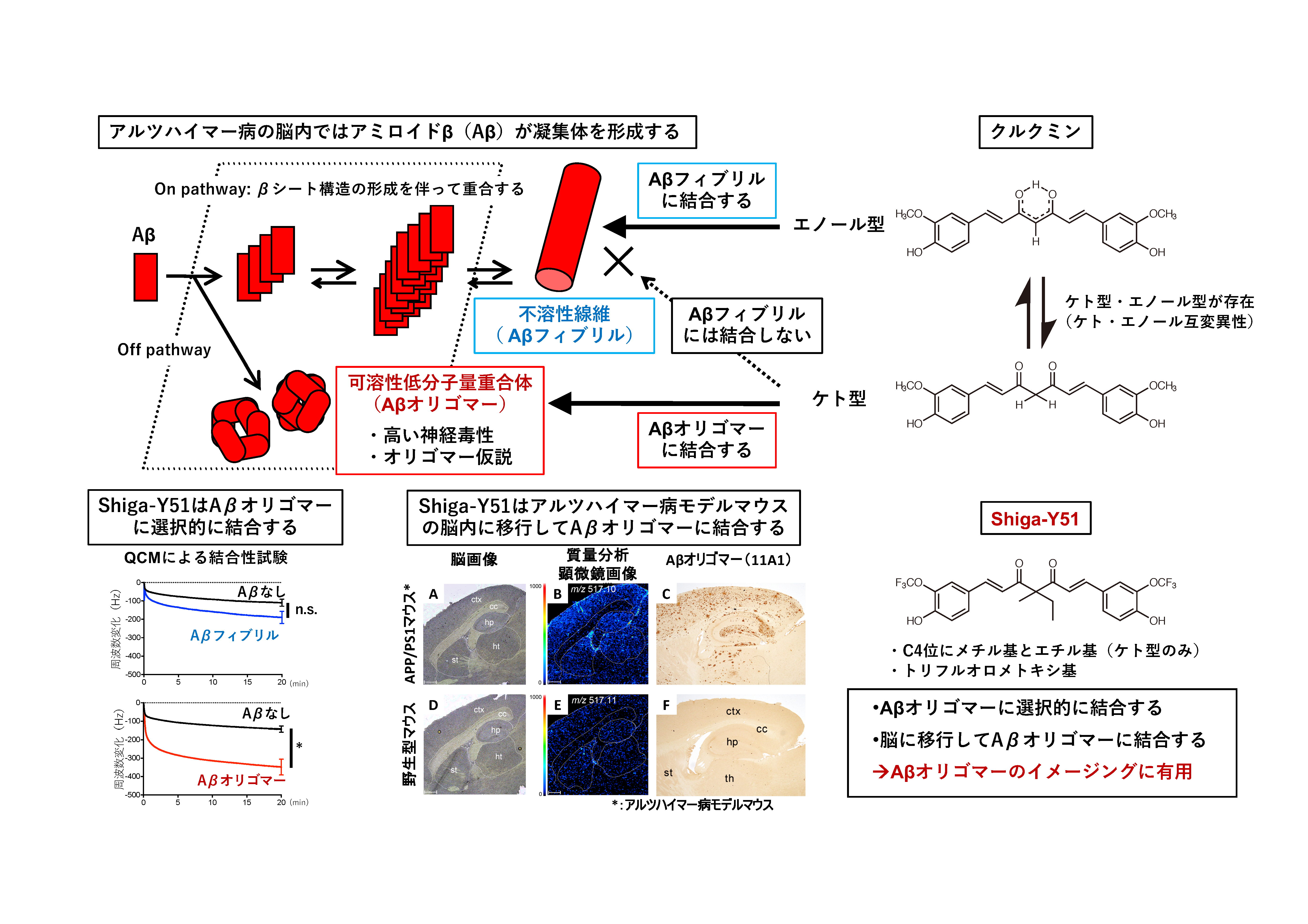
ケト型のクルクミン誘導体はAβオリゴマーに結合するがフィブリルには結合しない
論文タイトル
Keto form of curcumin derivatives strongly binds to Aβ oligomers but not fibrils
掲載誌
Biomaterials
10.1016/j.biomaterials.2021.120686
執筆者
Daijiro Yanagisawa1, Tomoko Kato1, Hiroyasu Taguchi, Nobuaki Shirai, Koichi Hirao, Takayuki Sogabe, Takami Tomiyama, Keizo Gamo, Yukie Hirahara, Masaaki Kitada, IkuoTooyama*.
1Equally contribution, *Corresponding author(太字は本学の関係者)
論文概要
アルツハイマー病は認知症の原因の6割以上を占める疾患ですが、有効な根本治療薬は開発されていません。アルツハイマー病の発症と病態進行にはアミロイドβ(Aβ)の凝集体形成が深く関わっています。最近の研究では、古くから知られていた老人斑を形成しているAβフィブリルではなく、可溶性低分子量凝集体(オリゴマー)がアルツハイマー病の発症と病態進行のトリガーであるとの仮説が提唱されています。しかし、生体内のAβオリゴマーの挙動を解析する方法はなく、その役割の多くが不明のままです。我々はクルクミンのケト・エノール互変異性に着目した研究を進めてきました。クルクミンはAβのフィブリルとオリゴマーの両方に結合性を示す低分子化合物です。クルクミンにはケト型とエノール型の互変異性体が存在しますが、Aβフィブリルとの結合時にはエノール型をとっています。一方、ケト型ではAβフィブリルとの結合性が著しく低下しています。本研究では、これまでの知見を基に、「クルクミンのケト型はAβオリゴマーに選択的に結合する」と仮説を立て、この仮説を、ケト型クルクミン誘導体Shiga-Y51を用いた実験によって証明しました。さらに、Shiga-Y51が血液脳関門を通過することや脳への集積量がアルツハイマー病モデルマウスで増加することを明らかにしました。本研究はケト型クルクミン誘導体がAβオリゴマーのイメージングプローブとして有用である可能性を示唆するもので、Aβオリゴマーの理解とアルツハイマー病の病態解明に寄与することが期待される成果です。
文責
柳沢大治郎(神経難病研究センター)、遠山育夫(研究等担当理事)
カニクイザルにおけるSARS-CoV-2に対する中和抗体依存性と非依存性免疫反応
論文タイトル
Neutralizing antibody-dependent and -independent immune responses against SARS-CoV-2 in cynomolgus macaques.
掲載誌
Virology
執筆者
Hirohito Ishigaki, Misako Nakayama, Yoshinori Kitagawa, Cong Thanh Nguyen, Kaori Hayashi, Masanori Shiohara, Bin Gotoh, Yasushi Itoh.
(太字は本学の関係者)
論文概要
新型コロナウイルスの感染が全世界に広がっており、死者や重症者が多数報告され、対策が喫緊の課題です。ワクチンや治療薬の開発では、動物を使わない研究だけでは副作用や生体反応の予測が困難であるため、動物を使い有効性と安全性を確かめる必要があります。そのため、このウイルスが感染し、患者と似た症状を示す動物を使うことが適切と考えられます。そこで私共のグループは、滋賀医科大学動物生命科学研究センターの感染実験室において、新型コロナウイルスをカニクイザルに感染させ、症状や免疫反応を解析しました。 ウイルスに感染した翌日には、サルは発熱し、3頭中1頭ではX線検査で肺炎が確認されました。また、感染力をもつウイルスが感染から7日目まで鼻腔や口腔などに検出されました。感染10日目には、ウイルスに結合し、感染を防御する免疫タンパク質である中和抗体が1頭のサルに検出され、感染から治癒したと考えられました。他の2頭のサルでは、中和抗体の産生はみられませんが、ウイルスに反応するTリンパ球が増加しました。このように新型コロナウイルスに対する中和抗体またはTリンパ球が機能すると治癒することがわかり、これらの免疫反応をワクチンにより強化できると感染予防に働くことが期待されます。
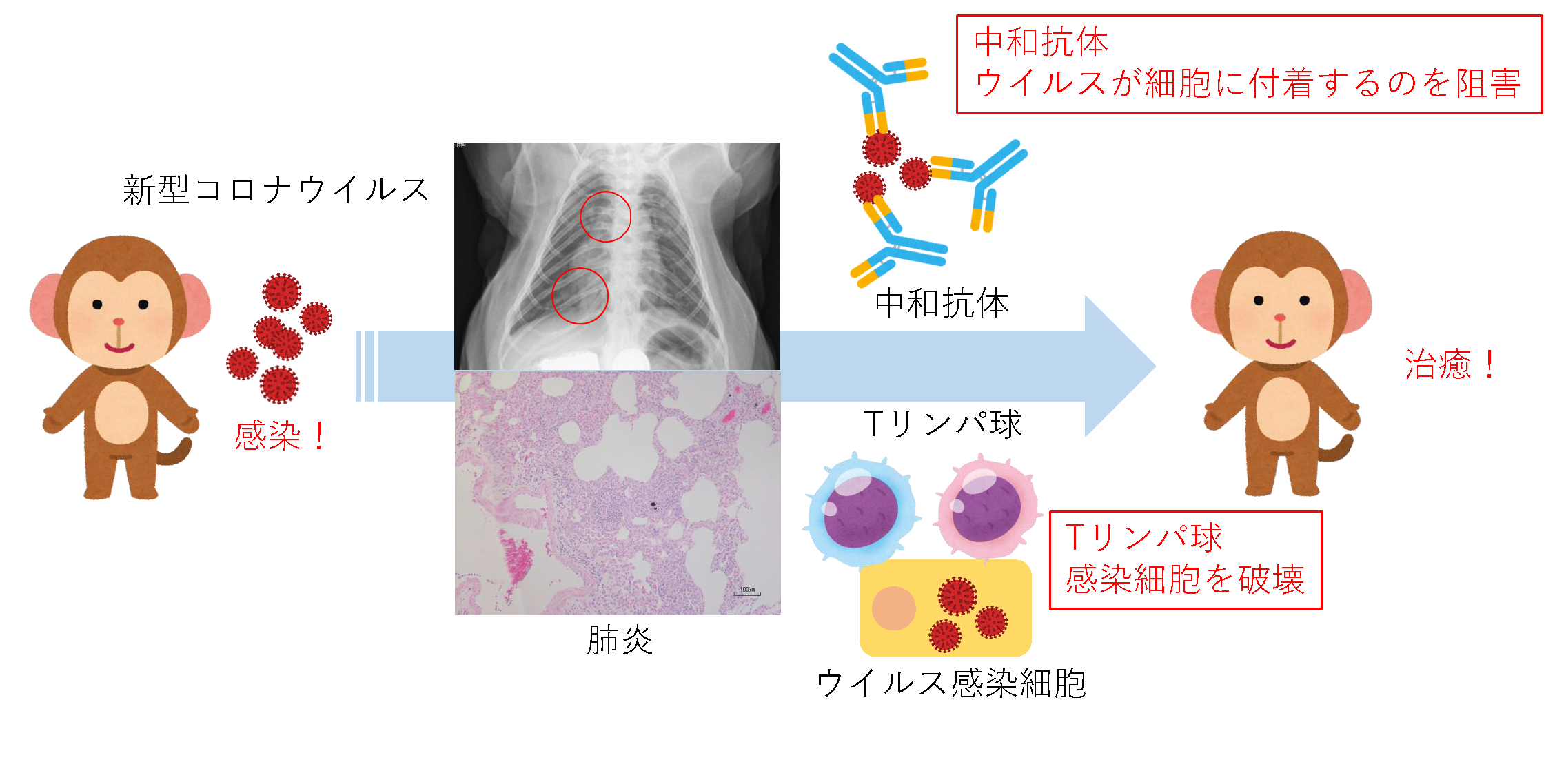
また他の2頭のサルでは、中和抗体は誘導されませんでしたが、新型コロナウイルスに反応するTリンパ球が増加しました。 新型コロナウイルスに対しては、中和抗体だけでなく、Tリンパ球もウイルスの排除に関与すると考えられ、今後のワクチンの有効性に期待が持てる結果となりました。 また、3頭とも感染から28日までに重症化することはなく、治癒したと考えられます。8割の感染者は軽症から中等症であることから、カニクイザルにおいても同様の症状であったと考えられます。
文責
病理学講座(疾患制御病態学部門) 石垣 宏仁、伊藤 靖
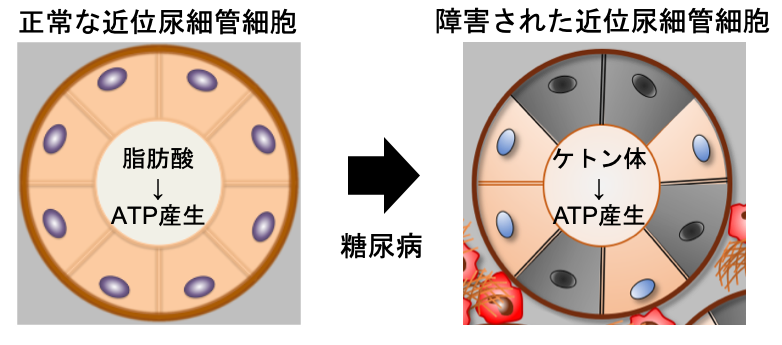
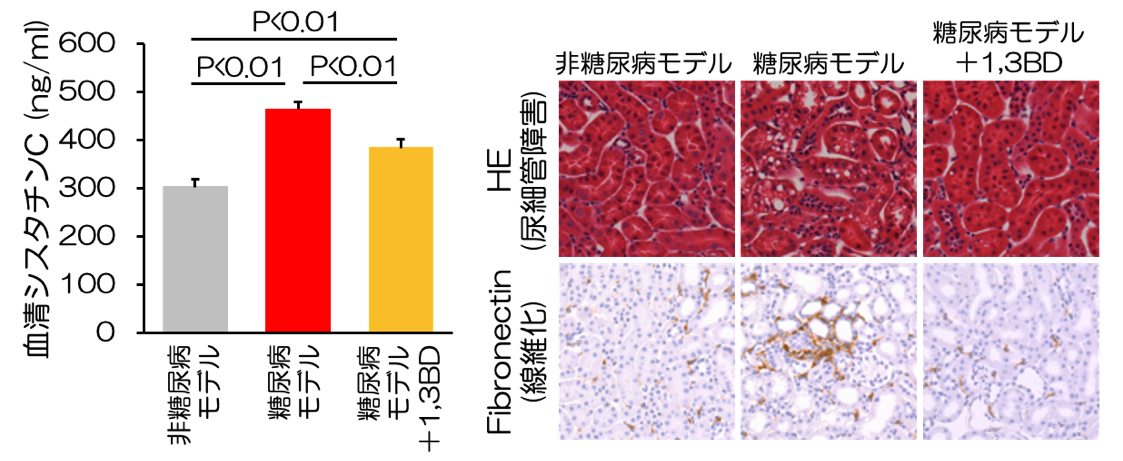
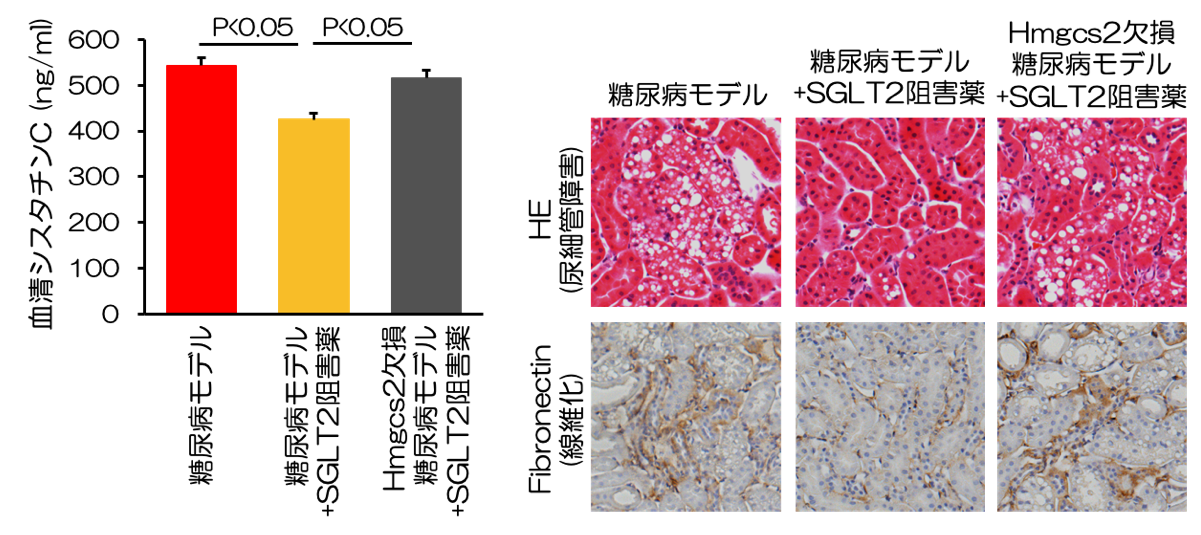
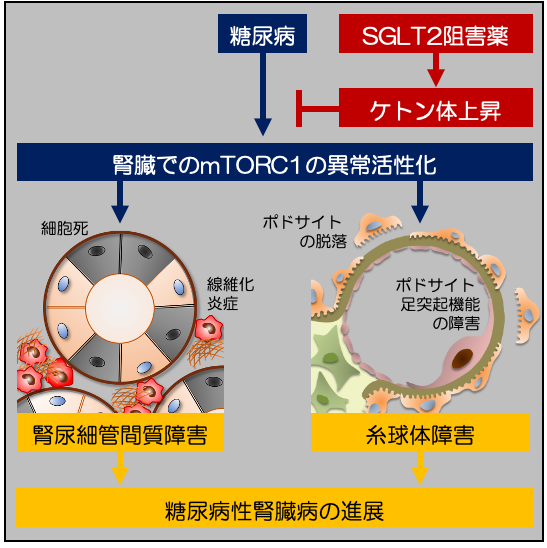
ケトン体が糖尿病性腎臓病における腎組織修復の鍵となる
−糖尿病性腎臓病克服への可能性に期待−
論文タイトル
SGLT2 Inhibition Mediates Protection from Diabetic Kidney Disease by Promoting Ketone Bodyinduced mTORC1 Inhibition
掲載誌
Cell Metabolism
執筆者
Issei Tomita, Shinji Kume, Sho Sugahara, Norihisa Osawa, Kosuke Yamahara, Mako YasudaYamahara, Naoko Takeda, Masami Chin-Kanasaki, Tatsuroh Kaneko, Eric Mayoux, Michael Mark, Motoko Yanagita, Hisakazu Ogita, Shin-ichi Araki, Hiroshi Maegawa
(太字は本学の関係者)
論文概要
糖尿病性腎臓病(DKD)は我が国の新たな透析導入の原因疾患として最多であり、その重症化を予防することは患者さんの生活の質の維持だけでなく、医療経済の観点からも重要な課題と言えます。本研究ではDKDモデルマウスを用いた検討により、ケトン体が糖尿病から腎臓を守る新たな治療標的となる可能性を発見しました。 正常な腎臓の近位尿細管細胞では、細胞の形態維持や生命活動に必要なATPというエネルギーを生み出すために脂肪酸を利用しますが、DKDモデルマウスでは脂肪酸利用が低下し、腎障害の悪化を引き起こします(図1)。同マウスにケトン体を投与すると、腎内ATP産生の回復、腎障害の改善が確認されました(図2)。次に、既存の血糖降下薬には見られない腎保護作用を示したSGLT2阻害薬(エンパグリフロジン)におけるケトン体の関与を検証することとしました。ケトン体を作るのに欠かせない酵素であるHmgcs2を欠損させたDKDモデルマウスを作製し、SGLT2阻害薬の効果を検証したところ、同マウスではSGLT2阻害薬による腎保護作用が消失しました(図3)。さらに、DKD病態進展に関与するmTORC1というタンパク質の働きを抑え、細胞内エネルギー代謝を改善させることが、ケトン体による腎組織修復メカニズムに重要であることを明らかにしました(図4)。本研究によりDKDに対して、ケトン体によるエネルギー供給およびmTORC1活性抑制が、SGLT2阻害薬による腎保護に寄与することを明らかにしました。ケトン体には糖尿病性ケトアシドーシス(注1)という合併症の原因物質といったネガティブなイメージが根付いていますが、至適濃度でのケトン体供給はDKDの新規治療標的となる可能性を示しました。
(注1)糖尿病性ケトアシドーシス: 高血糖、血中ケトン体の蓄積と酸血症(アシドーシス)をきたす、糖尿病での致死的な急性合併症。インスリンの作用不足の結果、ブドウ糖を分解してエネルギーにできず高血糖をきたす。また、脂肪をエネルギーとして利用しようとすることで、脂肪から分解されるケトン体の産生が亢進した結果、高ケトン血症をきたす。
文責
内科学講座(糖尿病内分泌・腎臓内科) 富田 一聖
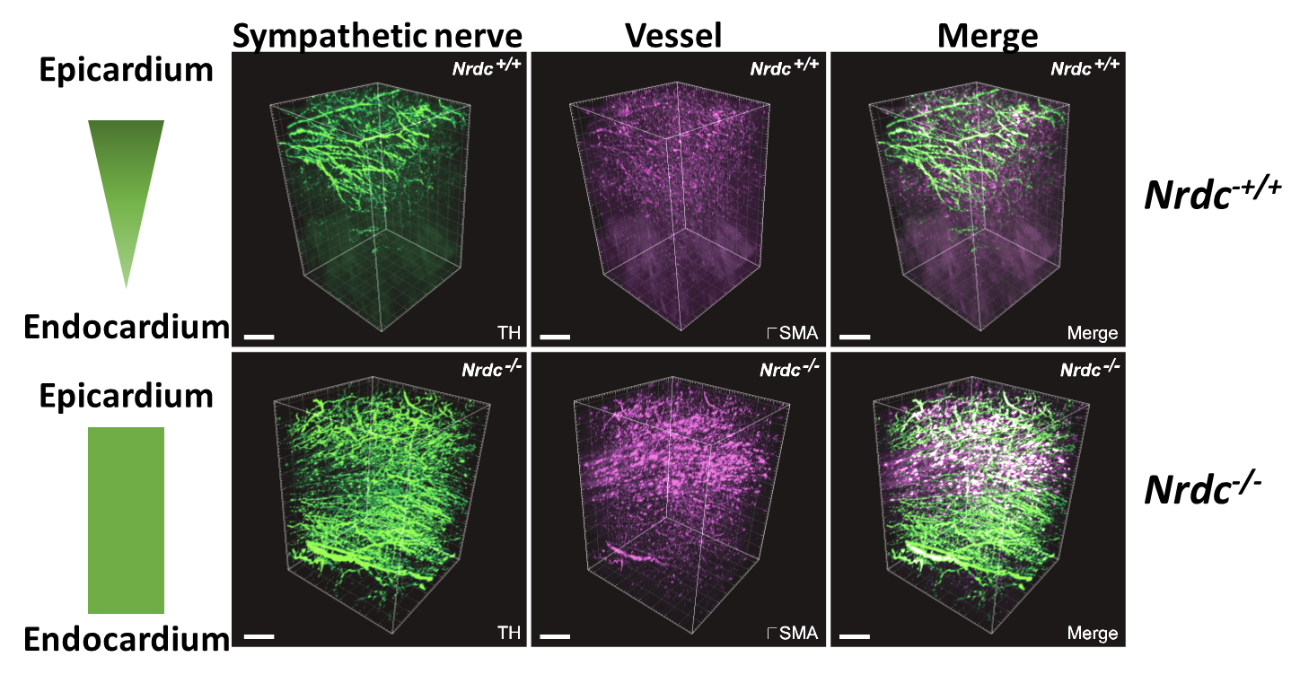
ナルディライジンはp75NTRの細胞外ドメイン切断を介して心臓交感神経の分布様式を制御する
論文タイトル
Nardilysin controls cardiac sympathetic innervation patterning through regulation of p75 neurotrophin receptor
掲載誌
The FASEB Journal, 2020 (in press)
執筆者
Mikiko Ohno, Kiyoto Nishi, Yoshinori Hiraoka, Shinichiro Niizuma, Shintaro Matsuda, Hirotaka Iwasaki, Takeshi Kimura, & *Eiichiro Nishi
(太字は本学の関係者)
論文概要
自律神経、なかでも交感神経は冠動脈に沿って走行し、洞房結節などの刺激伝導系や作業心筋に分布して、血圧や心拍数を調節しています。
私たちはこれまでに、ナルディライジン(Nardilysin:NRDC)というタンパク質を欠損するマウス (Nrdc-/-) が、髄鞘形成不全や低体温、インスリン分泌不全などの多彩な表現型を示すことを報告してきましたが、今回同マウスが徐脈や低血圧を呈することを新たに見出しました。
Nrdc-/-は徐脈・低血圧を示すにも関わらず、高カテコラミン血症を示したことから、心臓交感神経の分布を調べたところ、野生型マウスと大きく異なる分布様式を呈しました。すなわち野生型の交感神経が、左心室の心外膜側に多く心内膜側には少ない(図1上側)のに対し、Nrdc-/-では交感神経が心内膜側へと過剰に入り込むことで、その極性が消失していることが分かりました(図1下側)。過去の報告から、神経栄養因子 (NGF) が交感神経分布を正に制御することがわかっていましたが、意外なことにNrdc-/-の心臓ではNGFが低下していました。NGFの受容体 (TrkA, p75NTR) について解析したところ、Nrdc-/-では両受容体発現の増加を認め、p75NTRについてはタンパク質発現のパターンが変化していました。私たちはこれまでに、NRDCが種々の膜タンパク質の細胞外ドメイン切断を増強することを示しています。Nrdc-/-の心臓において、p75NTRの切断型が減少し、全長型が増加していたことから、NRDCがp75NTRの細胞外ドメイン切断を増強することが示唆されました。Nrdc-/-とp75NTR欠損マウスを交配してp75NTRの量を半分に減らす(Nrdc-/- : Ngfr+/-)ことで、交感神経の異常な分布様式が消失したことから、NRDCがp75NTRの細胞外ドメイン切断を介して、心臓交感神経の分布様式を制御することがわかりました (図2)。心筋梗塞の際に生じる心室性不整脈の発生には、心室に分布する交感神経の密度が関与するという知見もあることから、今回の知見はその発生機構などにもつながる研究成果として、FASEB Journalに報告しました。
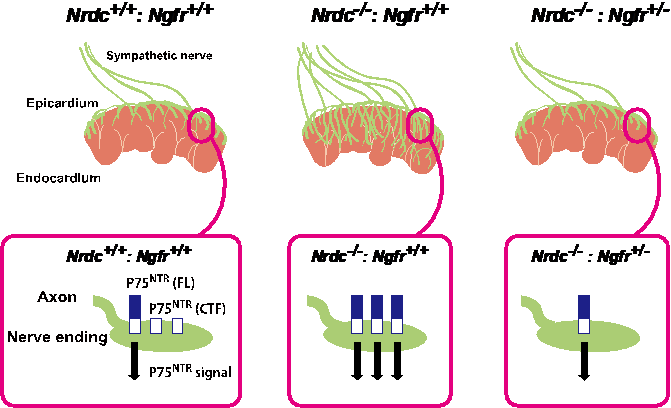
文責
大野 美紀子、西 英一郎(薬理学講座)
吸入麻酔薬の膜電位依存性カリウムチャネルにおける作用部位の特定
論文タイトル
Open-channel blocking action of volatile anesthetics desflurane and sevoflurane on human voltage-gated Kv1.5 channel
掲載誌
British Journal of Pharmacology, 2020 (in press)
執筆者
Yutaka Fukushima, Akiko Kojima, Xinya Mi, Wei-Guang Ding,Hirotoshi Kitagawa, Hiroshi Matsuura
(太字は本学の関係者)
論文概要
全身麻酔に用いる吸入麻酔薬は様々なイオンチャネルの機能を修飾し、全身麻酔作用や心臓作用などをもたらします。しかし古来より、吸入麻酔薬の作用部位は細胞膜の脂質二重層であると考えられてきました(Meyer-Overtonの法則)。近年、麻酔薬がGABAA受容体チャネルなどのリガンド依存性イオンチャネルに対して、それを構成するアミノ酸に直接作用してその機能を修飾することが明らかにされてきています。本研究では、吸入麻酔薬であるデスフルランとセボフルランが、膜電位依存性カリウムチャネルであるヒトKv1.5(hKv1.5)チャネルのポア領域に存在する複数のアミノ酸に直接作用して、hKv1.5チャネルを抑制することを明らかにしました。
培養細胞に発現させたhKv1.5チャネルに対するデスフルラン、セボフルランの効果をパッチクランプ法により解析したところ、これらの吸入麻酔薬はともにhKv1.5電流を抑制しました(図1)。
次に、hKv1.5チャネルに部位特異的点変異導入法を用いて変異体を作成し、デスフルラン、セボフルランの抑制効果を調べました。その結果、3種類の変異体ではhKv1.5チャネルに対する抑制作用が減弱したため、デスフルラン、セボフルランはこれらのアミノ酸(Thr480、Val505、Ile508)に作用して抑制作用を及ぼすと考えられます(図2)。
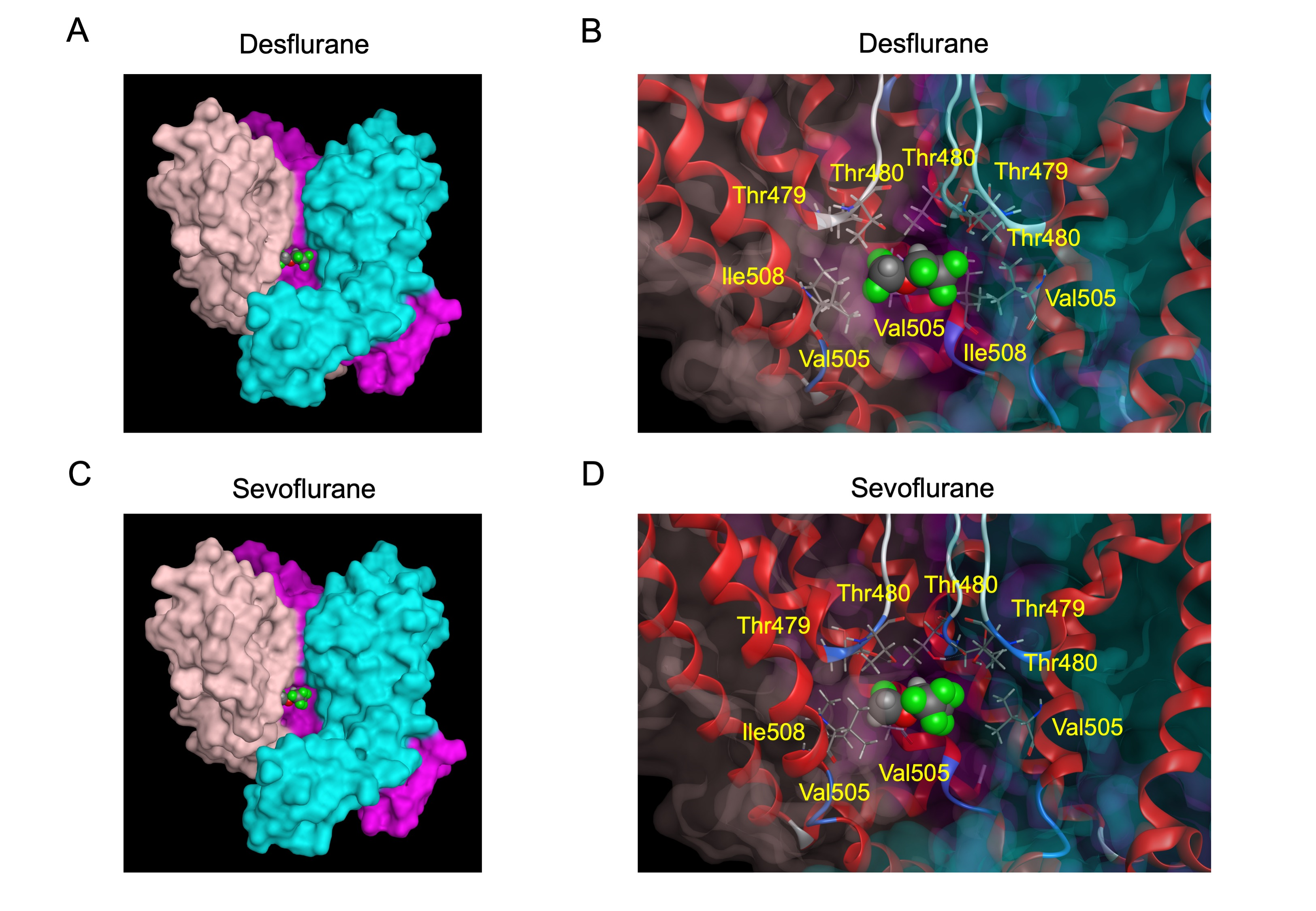
最後に、デスフルラン、セボフルランとhKv1.5チャネルとの結合をコンピューターシミュレーションで検討したところ、これらの吸入麻酔薬は点変異導入法で予測されたアミノ酸の近傍で安定して存在すると推定されました(図3)。
イオンチャネル発現細胞および数理モデルを用いて、吸入麻酔薬のイオンチャネルにおける作用部位を特定した本研究は、麻酔薬のイオンチャネル修飾機構の解明につながります。
図1 デスフルランおよびセボフルランによるhKv1.5 チャネル電流の抑制
(A)膜電位プロトコール(上図)と記録されたhKv1.5電流(下図)。デスフルラン(18%)存在下ではhKv1.5電流は抑制された(青)。(B)同プロトコールで記録された薬剤非存在下(黒)およびセボフルラン(8%)存在下(黄)のhKv1.5電流。
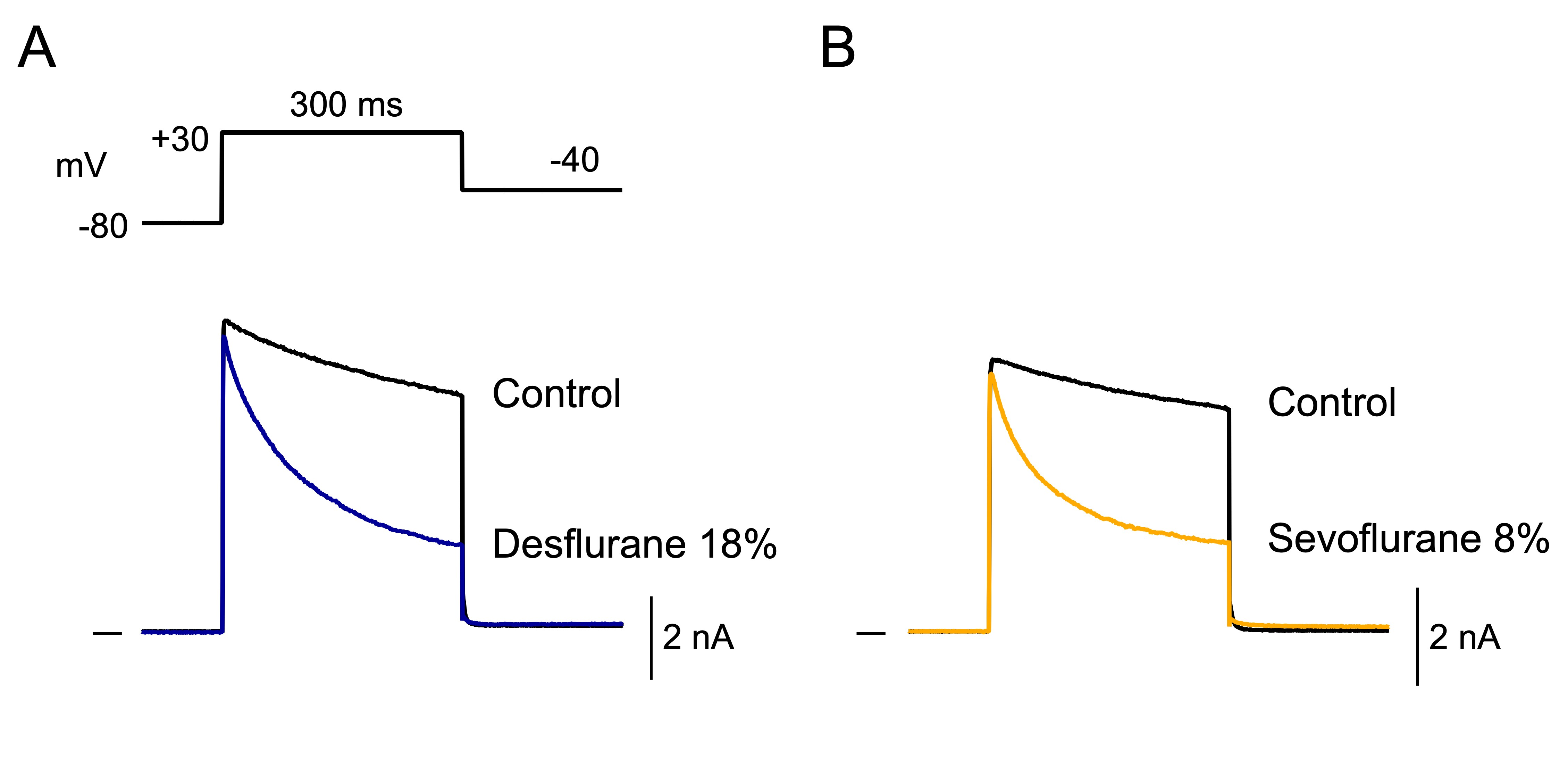
図2 デスフルランおよびセボフルランによる野生型hKv1.5チャネル電流と変異体チャネル電流に対する抑制作用の比較
3つの変異体(T480A、V505A、I508A)において、デスフルラン18%(A)、セボフルラン8%(B)による抑制作用の減弱がみとめられた。
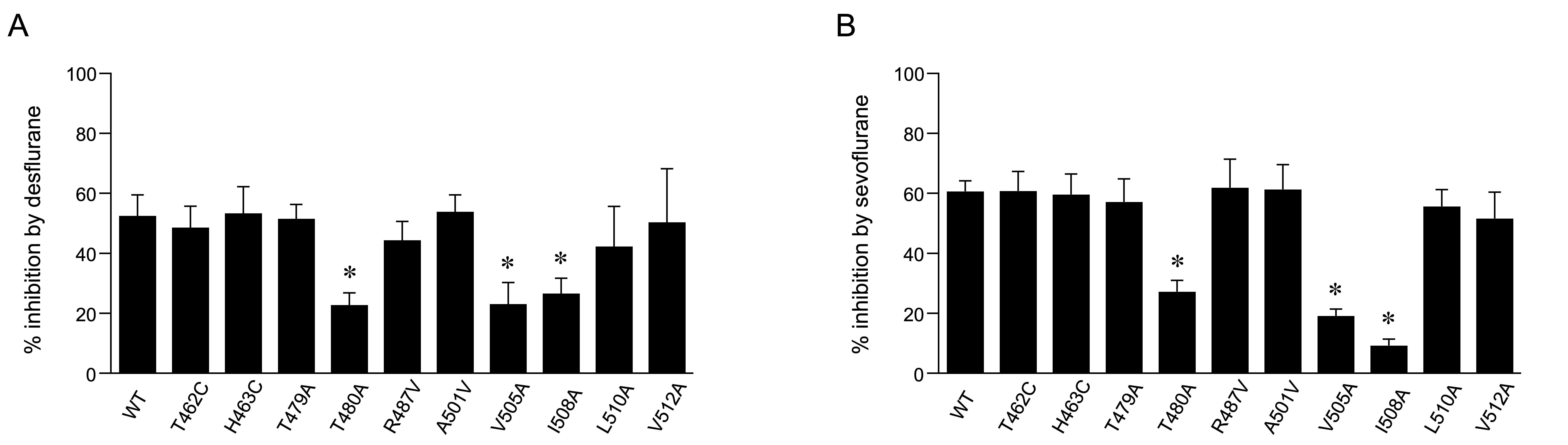
図3 コンピューターシミュレーション法によるhKv1.5チャネルとデスフルラン、セボフルランとの結合状態の推測
デスフルラン(A)およびセボフルラン(C)は、hKv1.5チャネルポアのイオン選択性フィルターの基部に位置する。hKv1.5チャネルと結合したデスフルラン(B)、セボフルラン(D)の拡大図。この位置のデスフルラン、セボフルランはThr479、Thr480、Val505およびIle508と隣接する。
文責
福島 豊(生理学講座細胞機能生理学部門、麻酔学講座)、小嶋 亜希子(麻酔学講座)、松浦 博(生理学講座細胞機能生理学部門)
―あたらしい心電図の指標-QT延長症候群8型においてLate appearance T waveは予後予測に有用である
論文タイトル
High Prevalence of Late-Appearing T-Wave in Patients with Long QT Syndrome Type 8
掲載誌
Circulation Journal 84(4): 559-568 (2020)
執筆者
Fukuyama M, Ohno S, Ozawa J, Kato K, Makiyama T, Nakagawa Y, Horie M.
(太字は本学の関係者)
要旨
QT延長症候群(LQTS)は心筋イオンチャネルをコードする蛋白の遺伝子変異により引き起こされる遺伝性疾患であり、現在16種類の原因遺伝子が同定されています(LQT1-16)。このうち8番目に位置するLQT8(別名Timothy症候群)はL型心筋カルシウムチャネル蛋白(CaV1.2)の機能亢進によることが明らかとなっており、心筋ナトリウムチャネル蛋白(NaV1.5)の機能亢進によるLQT3と臨床的に類似している点も多く見られます。そして、LQTSの心電図学的特徴として、QT時間の延長のみならず、特殊なT波の形状をとることがあります。LQT1・2・3型においては、高率に特徴的なT波形状を有するため、T波形状に基づいて遺伝子診断を待たずにLQTSの病型を推察することができます。今回の研究では、LQT8におけるT波形状と臨床像との関連を調査し、T波形状が診断・予後予測因子となり得るかを検討しました。
方法として、我々の遺伝性不整脈コホートにおいてLQT8と診断された症例において、心電図のT波形状の特徴並びに臨床像との関連を後ろ向きに調査しました。T波形状に基づいて患者群を1) Early onset(早いタイミングでT波が出現)、2) Late appearance(遅いタイミングでT波が出現)、3) Bifid(T波が2相性に出現)の3群に分け(図2のA, B, Cに対応)、心イベントの出現頻度や臨床的予後、遺伝学的特徴について、LQT3との比較も含めて調査を行いました。
結果、対象となったLQT8の17家系(25名)のうち、LQT8群ではlate appearance T waveの割合が多く、68%を占めていました (LQT3は52%でした)。QTc時間などのパラメータはT波形状ごとで有意差はなく、LQT3との有意差も認められませんでしたが、致死的不整脈発作を生じた症例はLQT8群・LQT3群ともに全例late appearance T waveを呈していました (図3)。分子生物学的な解析では、LQT8の変異はdomain I-II・II-IIIのlinkerに多く見られ、特に重症例の遺伝子変異は全て同領域に存在していました (図4)。 このことから、LQT8のT波形状は、late appearance T waveは致死的不整脈の新しい予後予測因子(指標)として有用である可能性が示唆されました。
![[図1] Circulation Journal 2020年84巻4号 :当該論文の図が表紙を飾りました。](/sites/default/files/inline-images/Cover.png)
![[図2]LQT8患者の心電図に見られる3種のT波形状: (B)のlate-appearance T waveが一番多く全体の68%を占めています。](/sites/default/files/inline-images/T-wave_0.png)
![[図3] LQT8群のうち有症状は9名、LQT3群では10名でした。このうち、心肺停止に至る致死的不整脈に至った者(図の赤+青)はそれぞれ5名ずつでしたが、高率にLaTを呈していました。](/sites/default/files/inline-images/LQTchart.png)
![[図4] L型心筋カルシウムチャネルαサブユニットの模式図。多くの変異が細胞内linkerに存在しています。](/sites/default/files/inline-images/Chart4.png)
文責
循環器内科・福山 恵、アジア疫学研究センター・堀江 稔
アミロイドβ前駆体タンパク質を発現するアルツハイマー病モデルカニクイザルの作出に成功
論文タイトル
Generation of Transgenic Cynomolgus Monkeys overexpressing the Gene for Amyloid-β Precursor Protein.
掲載誌
Journal of Alzheimer’s Disease 2020 Pre-press
執筆者
Seita Y, Morimura T, Watanabe N, Iwatani C, Tsuchiya H, Nakamura S, Suzuki T, Yanagisawa D, Tsukiyama T, Nakaya M, Okamura E, Muto M, Ema M, Nishimura M, Tooyama I.
(太字は本学の関係者)
要旨
アルツハイマー病(AD)は認知症の60〜70%を占めている最も多い原因疾患であり、アルツハイマー病の病因を解明することは治療法の開発と新たな診断法の確立に繋がると期待されています。家族性アルツハイマー病の患者では、脳内にアミロイドβ(Aβ)が増加し、Aβが神経細胞外に沈着した老人斑が出現し、神経原線維変化、神経細胞死の順に脳病理が進行しますが、老人斑のみでは認知症の症状はほとんど出現しないことが知られています。すなわち、老人斑から神経原線維変化へ進展するメカニズムを解明し、それを防ぐことが治療法の開発につながると考えられます。 しかし、これまでのげっ歯類モデルでは老人斑は形成するものの神経原線維は形成しないことから、治療法を開発するための新たなモデル動物が待たれていました。これに対して、解剖学的・生理学的にヒトに類似するサルでは、ヒトと同じく高齢になると老人斑や神経原線維変化が脳に出現することが分かっていますが、時間がかかるのが課題で、かつ野生のサルでアルツハイマー病を発症したという報告はまだありません。
本研究では、家族性アルツハイマー型認知症で認められるSwedish, Arctic, Iberian 変異を導入したAPP遺伝子とGFPをコードする遺伝子を発現させた家族性アルツハイマー病モデルカニクイザルの作成に世界で初めて成功しました。このアルツハイマー病モデルカニクイザルはGFPの発現が毛包、末梢血で発現を示しているのみならず、血液中のAβ40レベルが野生型サルの約20倍に、Aβ42レベルが約50倍に増加しており、変異型APP遺伝子を発現していると考えられます。このアルツハイマー病モデルカニクイザルは全身で遺伝子を発現するCAGプロモーターを採用したことから挿入された遺伝子は表現型に影響を与える可能性がありますが、ヒトのアルツハイマー病と同様に、老人斑の出現から神経源繊維変化の形成、神経細胞死へ進展し、認知症を発症するかどうかをこのモデルで確認する必要があります。もし、これが確認できれば、ヒトのアルツハイマー病の進展機構を再現する世界初の動物モデルを得られたこととなり、アルツハイマー病の発症メカニズムを解明し、治療法の開発に役立つことが期待されます。
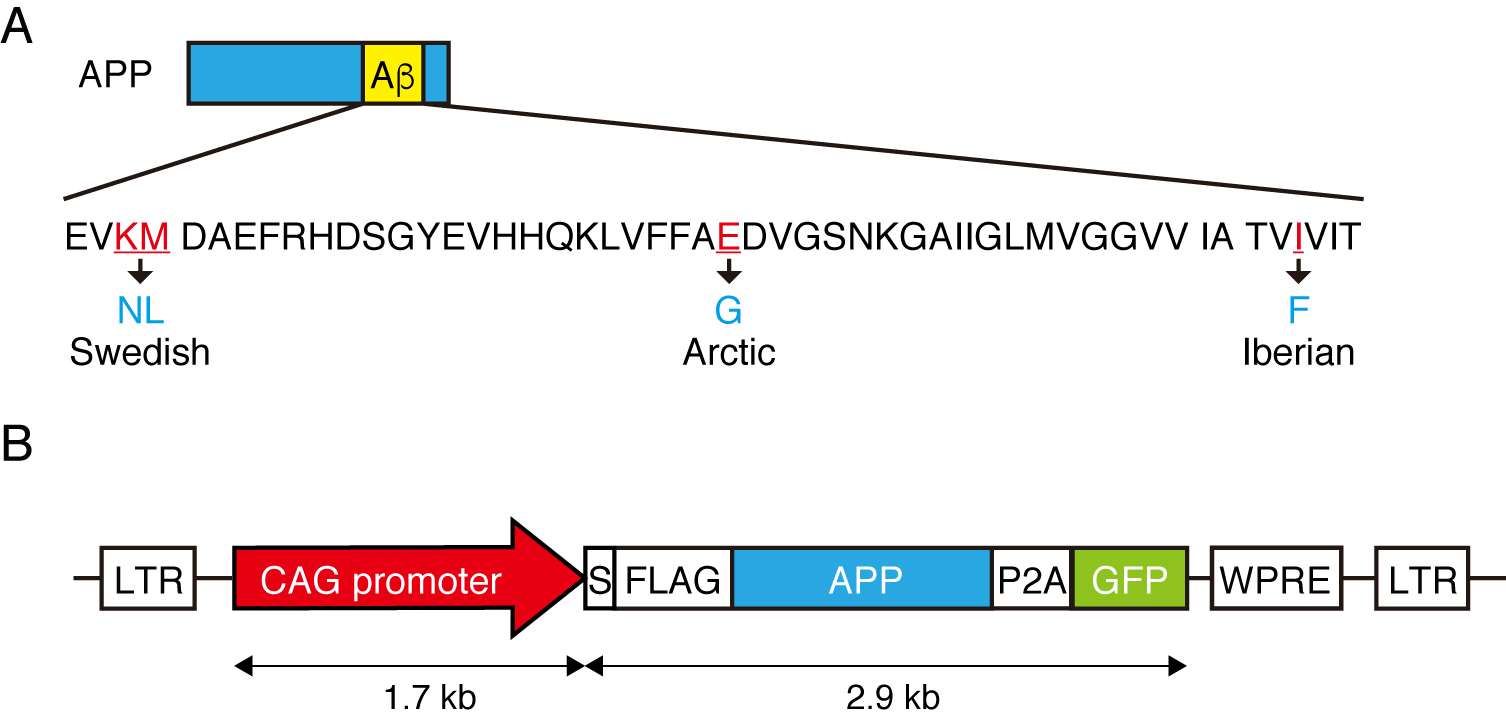
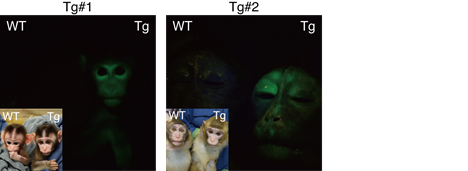

文責
動物生命科学研究センター 客員講師 清田 弥寿成
家族性ブルガダ症候群でtransmembrane protein 168遺伝子の新規変異を同定
論文タイトル
Identification of transmembrane protein 168 mutation in familial Brugada syndrome.
掲載誌
FASEB JOURNAL 2020 in press.
DOI: doi: 10.1096/fj.201902991R
執筆者
Shimizu A, Zankov DP, Sato A, Komeno M, Toyoda F, Yamazaki S, Makita T, Noda T, Ikawa M, Asano Y, Miyashita Y, Takashima S, Morita H, Ishikawa T, Makita N, Hitosugi M, Matsuura H, Ohno S, Horie M, Ogita H.
(太字は本学の関係者)
要旨
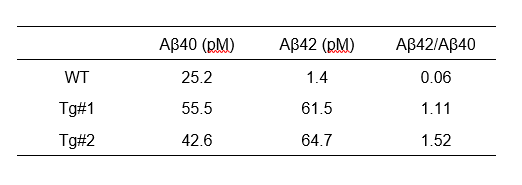
ブルガダ症候群は心電図上で特徴的な波形を示し、心室細動などの致死的不整脈による突然死と関連することが報告されています。日本を含むアジア諸国での頻度は人口1万人当たり約12人と推定されています。ところで、ブルガダ症候群の約70%は原因不明のままです。本研究では、原因不明のブルガダ症候群の家系に着目して網羅的な遺伝子解析を行い、患者さんでのみTransmembrane protein 168(TMEM168)遺伝子内の1616番目のグアニン塩基(G)がアデニン塩基(A)に変異していること(図1)、その結果、TMEM168タンパク質の539番目のアミノ酸がアルギニンからグルタミンに変化していることを新たに突き止めました。
この遺伝子変異により、心筋での電気信号を伝えるナトリウムチャネルの機能が低下していました。そのために致死的不整脈が出現しやすくなっていることを、培養心筋細胞を用いた実験や遺伝子改変モデルマウスを作製して証明しました。この遺伝子変異(Tmem168 1616G>A)をもつモデルマウスに薬剤を負荷すると、ブルガダ症候群患者と同様の心電図の異常が見られ、約30%のマウスで致死的不整脈が出現しました(図2)。
次に、このTMEM168遺伝子変異によりナトリウムチャネルの機能が低下するメカニズムを調べました。その結果、このチャネルを構成するタンパク質が、TMEM168遺伝子変異のために過剰に分解されてしまい、心筋細胞におけるそのタンパク質の発現量が減少していることを明らかにしました(図3)。
以上より今回の研究では、ブルガダ症候群の原因の一つとしてTMEM168遺伝子異常が関わっていること、この遺伝子異常で致死的不整脈による突然死が起こり易くなっていることと、さらに、その分子メカニズムを世界に先駆けて明らかにしました。
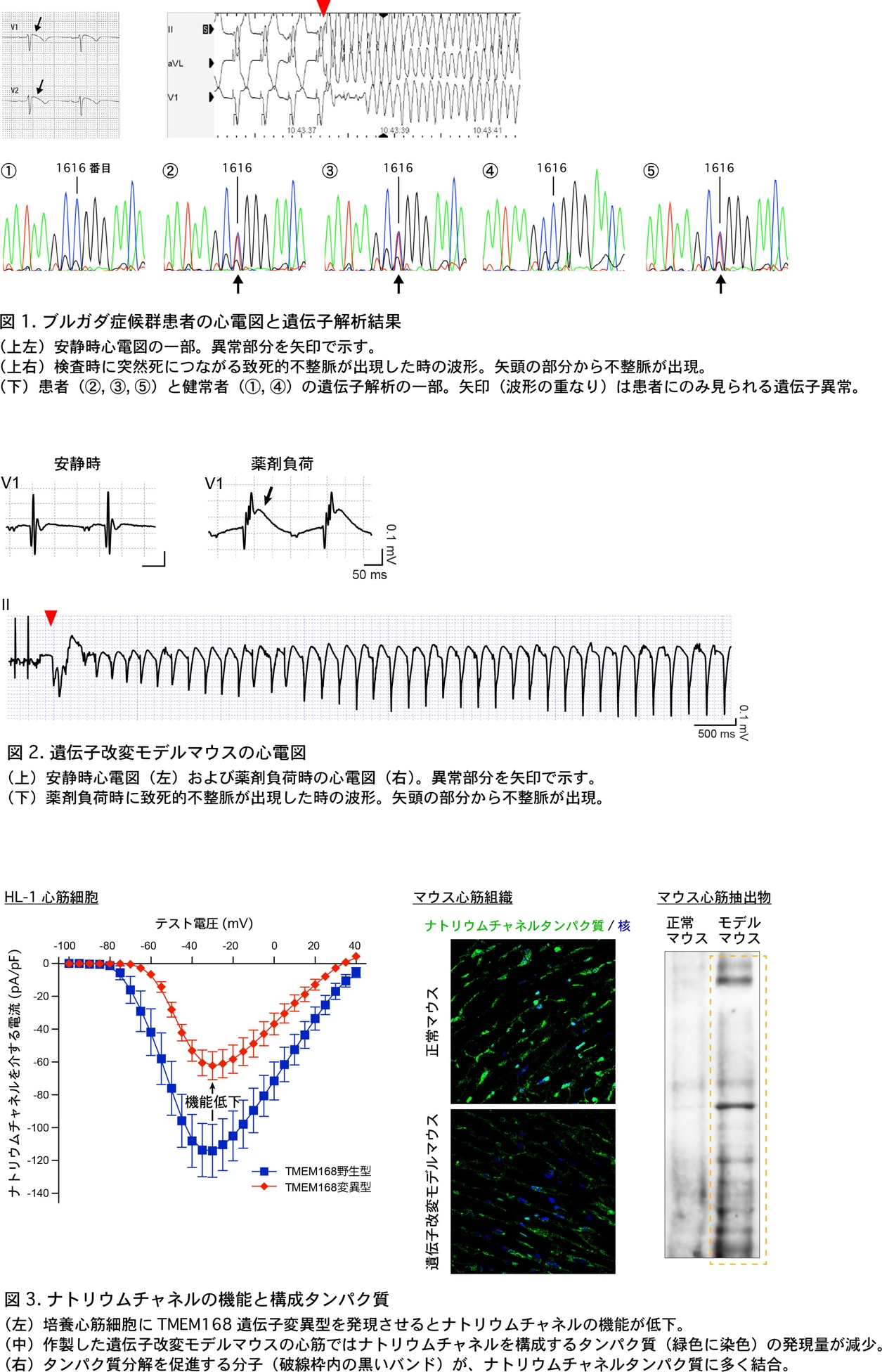
文責
扇田 久和 (生化学・分子生物学講座(分子病態生化学部門))
PKD1に変異を持つサルはヒトの常染色体優性多発性嚢胞腎を再現する。
論文タイトル
Monkeys mutant for PKD1 recapitulate human autosomal dominant polycystic kidney disease
掲載誌
Nature Communications
DOI: 10.1038/s41467-019-13398-6
執筆者
(* Corresponding author, # Equal contribution)
概要
本研究では、本学の特色の一つであるカニクイザルを用い、CRISPR/Cas9法を用いたゲノム編集により、ヒトで最も頻度の高い遺伝的腎疾患である常染色体優性多発性嚢胞腎(ADPKD)の病態再現に成功しました。 PKD1遺伝子のヘテロ接合体変異によって引き起こされるADPKDは、世界中に約600万人の患者がいると言われています。しかし、げっ歯類などの小動物モデルでは、ヘテロ接合体では腎において嚢胞発生がほとんど見られず、ヒトの病態を正確に再現することができないため、発症前の段階における嚢胞発生と拡大の根底をなすキーとなる病態進行プロセスはよく分かっていませんでした。
本研究で作出されたカニクイザルADPKDモデル(図1)では、げっ歯類などの小動物モデルでは再現が困難であった、幼少期からの腎嚢胞形成(図2)が確認され、今まで全く分かっていなかった病態形成の最初期の状態を明らかにすることができました。 さらに、早期に前臨床試験に使用できる嚢胞好発型に加え、ヒトの緩慢な病態進行を正確に再現できるヘテロ接合体モデルの特異的作製や、大きなDNA断片の標的遺伝子挿入(ノックイン)にも成功しました。 本研究で得られた知見により、従来治療標的とされてきた腎の集合管ではなく、遠位尿細管を標的とする新規薬剤の開発への道が拓かれるのみならず、作製されたサルモデルは新しい治療戦略を確立するための技術基盤となることが期待されます。

図1. 本研究で作出したADPKDモデルカニクイザル
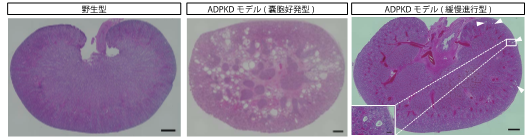
図2. ADPKDモデルカニクイザル腎における嚢胞形成
文責
築山 智之(動物生命科学研究センター)
モデル動物が群れをつくるメカニズムを解明
論文タイトル
C. elegans collectively forms dynamical networks
掲載誌
Nature Communications 10(1):683 (2019)
DOI: 10.1038/s41467-019-08537-y
執筆者
Takuma Sugi*, Hiroshi Ito*, Masaki Nishimura, Ken H. Nagai*
(*は責任著者)
概要
夕暮れどきに浮かぶ鳥の群れや水族館のイワシの群れなど、大量の動物による組織的な行動は多くの人を魅了します。混雑する駅やイベントなどの雑踏で人の群衆を効率的に流動させることは、重要な課題です。これまで、群れ形成について理論研究が盛んに行われ、それらに共通するメカニズムの存在が予言される一方、実験的証明はほとんどありませんでした。これは、動物の大規模な群れを実験室に再現することが難しいという、当然の理由によるものでした。
このメカニズムは、人や鳥、魚の群れ形成の理論的研究から提唱されてきたものと類似していることから、本研究は、群れ形成の根底に共通のメカニズムがあることを実験により強く示唆する初めての例となります。

図1 線虫がたくさん集まるとネットワーク状に群れをつくることを発見
文責
杉 拓磨(神経難病研究センター)
ベラパミルはヒトKv1.5チャネルのポア領域に結合してチャネルをブロックする
論文タイトル
Identification of verapamil binding sites within human Kv1.5 channel using mutagenesis and docking simulation
掲載誌
Cellular Physiology and Biochemistry 52:302-314 (2019)
DOI: 10.33594/000000022
執筆者
Wei-Guang Ding, Ayami Tano, Xinya Mi, Akiko Kojima, Tomoyoshi Seto, Hiroshi Matsuura
Wei-Guang Ding and Ayami Tano contributed equally to this work.
概要
カルシウム拮抗薬であるベラパミルは、心房細動や発作性上室性頻拍など頻脈性不整脈の治療に用いられます。一方、Kv1.5チャネルはヒト心臓においては主に心房筋に発現し、その活動電位持続時間を規定します。本研究では、ベラパミルがヒトKv1.5(hKv1.5)チャネルのポア領域に存在する複数のアミノ酸に結合して、hKv1.5チャネルに直接の抑制作用をおよぼすことを、明らかにしました。
はじめに、培養細胞に発現させたhKv1.5チャネルに対するベラパミルの効果を、パッチクランプ法により解析しました(図1)。ベラパミルは濃度依存性にhKv1.5チャネルを抑制し、その効果は臨床濃度(約0.1 µM)で出現しました。
次に、hKv1.5チャネルに部位特異的点変異を導入して変異体を作成し、ベラパミルの抑制効果を調べました。その結果、図2に示す6種類の変異体ではhKv1.5 チャネルに対する抑制作用が減弱したため、ベラパミルはこれらのアミノ酸(Thr479、Thr480、Val505、Ile508、Val512、Val516)に作用して抑制作用を及ぼしていると考えられます。
最後に、ベラパミルのhKv1.5チャネル結合状態をコンピュータ上で予測しました(図3)。その結果、ベラパミルは点変異導入法で予測されたアミノ酸との間で結合エネルギーが発生し、特にVal512とはπ-水素結合を形成することが予測されました。
Kv1.5チャネルを抑制することは、心房内を異常な興奮が旋回するリエントリーを主な機転とする心房性不整脈に対する有効な治療法の一つとなりえます。本研究の成果は、ベラパミルがリエントリー性不整脈に対して抗不整脈作用を及ぼす可能性を示唆しています。
なお、この研究は研究医コースの田埜郁実さん(医学科第6学年)が積極的に実験や論文作成に参加し(共第一著者)、その内容を平成29年度第3回SUMSグランドラウンド(平成29年7月24日)で発表しました。その時に学内の多くの先生方から研究の発展につながる貴重なコメントやアドバイス、激励をいただきましたことに深く感謝申し上げます。
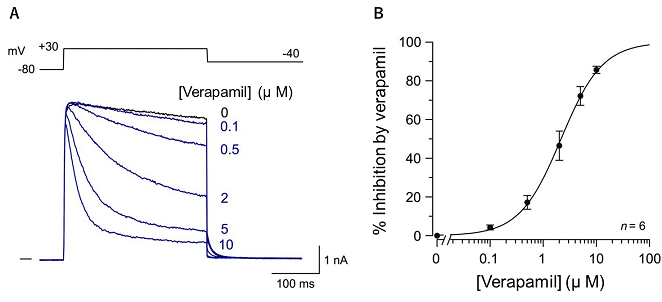
図1 ベラパミルによるhKv1.5チャネルの抑制効果 (A)種々の濃度のベラパミルによる hKv1.5チャネルの抑制 (B)ベラパミルによるhKv1.5チャネルの濃度依存性抑制効果
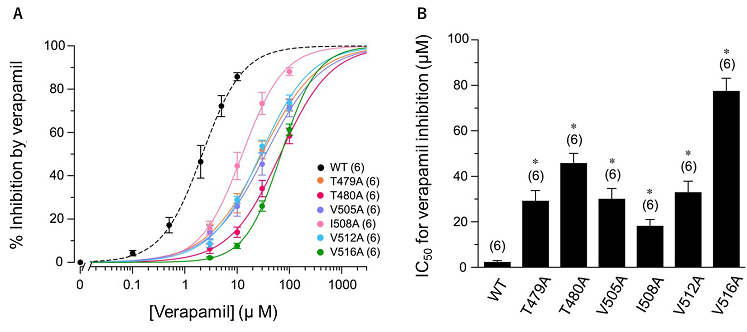
図2 ベラパミルによるhKv1.5チャネル変異体への抑制効果 (A)野生型および種々の変異体hKv1.5チャネルに対するベラパミルの濃度依存性抑制効果 (B)ベラパミルによる野生型および種々の変異体hKv1.5チャネルに対する抑制作用の半最大抑制濃度(IC50)
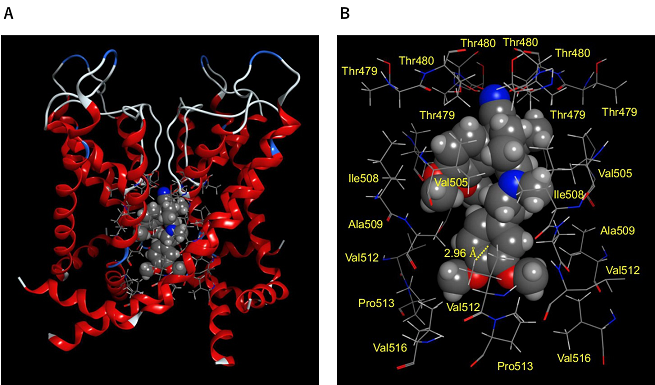
図3 コンピュータドッキングシミュレーション法によるベラパミルの結合状態の推測 (A)ベラパミルのhKv1.5チャネルの結合状態(B)パネルAの拡大図
文責
松浦 博 生理学講座(細胞機能生理学部門)
日本人患者における先天性QT延長症候群の遺伝的および臨床的側面と生命を脅かす不整脈との関連
論文タイトル
Association of Genetic and Clinical Aspects of Congenital Long QT Syndrome With Life-Threatening Arrhythmias in Japanese Patients
掲載誌
Aging JAMA Cardiol. 2019
DOI: 10.1001/jamacardio.2018.4925
執筆者
Wataru Shimizu, Hisaki Makimoto, Kenichiro Yamagata, Tsukasa Kamakura, Mitsuru Wada, Koji Miyamoto, Yuko Inoue-Yamada, Hideo Okamura, Kohei Ishibashi, Takashi Noda, Satoshi Nagase, Aya Miyazaki, Heima Sakaguchi, Isao Shiraishi, Takeru Makiyama, Seiko Ohno, Hideki Itoh, Hiroshi Watanabe, Kenshi Hayashi, Masakazu Yamagishi, Hiroshi Morita, Masao Yoshinaga, Yoshiyasu Aizawa, Kengo Kusano, Yoshihiro Miyamoto, Shiro Kamakura, Satoshi Yasuda, Hisao Ogawa, Toshihiro Tanaka, Naotaka Sumitomo, Nobuhisa Hagiwara, Keiichi Fukuda, Satoshi Ogawa, Yoshifusa Aizawa, Naomasa Makita, Tohru Ohe, Minoru Horie, Takeshi Aiba
概要
先天性QT延長症候群は、心電図でQT時間の延長という特徴的な波形を示す疾患です。多くは運動中や強いストレスなどで心室性不整脈を発症し、突然死の原因となります。約3/4の患者で心筋イオンチャネルに関連する遺伝子に異常を認め、そのほとんどがLQT1型、LQT2型、LQT3型のいずれの遺伝子型です。
本論文では、日本の先天性QT延長症候群の突然死や致死性不整脈イベント発生に、原因遺伝子の種類だけでなく、個々の患者の変異部位や年齢、性別が深く関係することを報告しています。
今回の研究では、国立循環器病研究センターをはじめ日本国内の11施設において計1,124例の先天性QT延長症候群患者(LQT1型521例、LQT2型487例、LQT3型116例)を集積し、遺伝子型および年齢・性別により致死性不整脈の発症に差異がみられるか後向きに長期追跡調査を行いました。調査の結果、まず遺伝子型別では、総イベント発生率はLQT1、2型に比べLQT3型で少ないが、致死性イベント(心室細動・心停止・突然死)の発生率には遺伝子型による差は認めず、総イベントに対する致死性イベントの占める割合はむしろLQT3型で高いことが明らかとなりました。そのほか、年齢や性別による発症率の違い、遺伝子異常の部位による影響等を詳しく検討しました。
文責
堀江 稔(アジア疫学研究センター最先端疫学部門)
